
Абсорбция газов
Категория реферата: Биология и химия
Теги реферата: дороги реферат, качество реферат
Добавил(а) на сайт: Бажанов.
1 2 3 4 | Следующая страница реферата
Абсорбция газов
Абсорбция газов (лат. absorptio, от absorbeo-поглощаю), объемное поглощение газов и паров жидкостью (абсорбентом) с образованием раствора. Применение абсорбции в технике для разделения и очистки газов, выделения паров из паро-газовых смесей основано на разл. р-римости газов и паров в жидкостях. Процесс, обратный абсорбции., наз. десорбцией; его используют для выделения из р-ра поглощенного газа и регенерации абсорбента. Поглощение газов металлами (напр., водорода палладием) наз. окклюзией. асорбция .- частный случай сорбции.
Различают физ. и хим. абсорбцию. При физической абсорбции энергия взаимод. молекул газа и абсорбента в р-ре не превышает 20 кДж/моль. При химической абсорбции (или абсорбция с хим. р-цией, часто наз. хемосорбцией) молекулы растворенного газа реагируют с активным компонентом абсорбента-хемосорбентом (энергия взаимод. молекул более 25 кДж/моль) либо в р-ре происходит диссоциация или ассоциация молекул газа. Промежут. варианты абсорбции характеризуются энергией взаимод. молекул 20-30 кДж/моль. К таким процессам относится растворение с образованием водородной связи, в частности А. ацетилена диметилформамидом.
Статика абсорбции. Характеризует термодинамич. равновесие р-ра с паро-газовой смесью, а также материальный и энергетич. балансы процесса. При физ. абсорбции с образованием идеального р-ра для р-рите-ля и растворенного газа во всем интервале изменения состава в соответствии с законом Рауля растворимость газа:
![]()
где Р°2- давление паров над чистым сжиженным газом при данной т-ре системы; р2 - парциальное давление газа; звездочкой обозначаются параметры в-ва в условиях равновесия. Индексы "1" и "2" относятся соотв. к р-рителю и газу. Идеальная р-римость x*2,ид-ф-ция только т-ры, св-ва р-ри-теля влияния на нее не оказывают.
Зависимость р-римости газов х*2 от их парциального давления при физ. абсорбции в бесконечно разбавленном р-ре (х2 ->0) и при низких давлениях Р в системе описывается законом Генри (рис. 1, прямые 1-3):
![]()
где КH-коэф. Генри, изменяющийся с изменением т-ры. Если абсорбция проводят под давлением, но х*2 ->0, р-римость газа можно рассчитать по уравнению Кричевского - Казарновского:
![]()
где
Кф-коэф. физ. р-римости, равный КH при х2-> 0 и Р-> -> 0;
f*2-летучесть газа;![]() -парциальный
мольный объем растворенного газа в жидкой фазе при бесконечном разбавлении; R-
универсальная газовая постоянная; Po1-давление насыщ. паров чистого р-рителя
при абс. т-ре системы Т. Если 0 < х*2
-парциальный
мольный объем растворенного газа в жидкой фазе при бесконечном разбавлении; R-
универсальная газовая постоянная; Po1-давление насыщ. паров чистого р-рителя
при абс. т-ре системы Т. Если 0 < х*2![]() (0,05-0,1)
молярной доли (разбавленные р-ры), то при низких давлениях справедливо ур-ние
Сеченова:
(0,05-0,1)
молярной доли (разбавленные р-ры), то при низких давлениях справедливо ур-ние
Сеченова:
![]()
где
А1,2-коэф., не зависящий от состава р-ра. 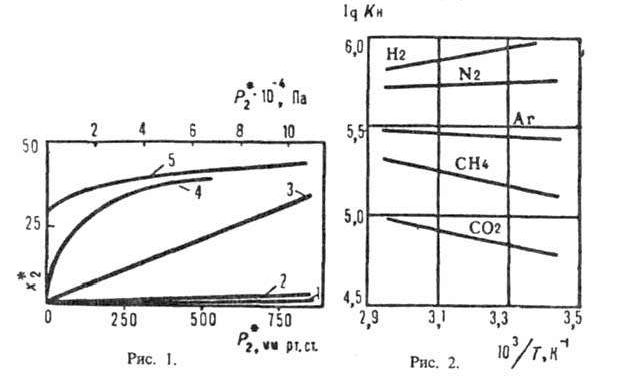
Рис. 1. Зависимость р-римости х2* нек-рых газов в жидкостях парциального давления газов над растворами: I- СО2 в воде при 20 °С; 2-СО2 в пропиленкар-бонате при 25 С; 3 С2Н4 в диметилформамиде при 25 °С; 4-СО, в водном о-ое содержащем 25% К2СО3 и 10% диэтаноламина при 60°C 5-СО, в 2,5 н водном р-ре моноэтаноламина при 20°С; х2* - в м3 газа (при нормальных условиях - 20°С и 0,1 МПа) на 1 м3 жидкости. 2
Рис. 2. Зависимость коэф. Генри (в мм рт. ст./молярные доли) для р-ров газов в додекане от т-ры.
Зависимость растворимости газа от температуры как при физ., так и при хим. абсорбции приближенно описывается ур-нием:
![]()
где![]() -тепловой
эффект растворения газа. Если р-р при А. нагревается,
-тепловой
эффект растворения газа. Если р-р при А. нагревается,![]() . С изменением т-ры
. С изменением т-ры![]() обычно либо остается постоянной, либо незначительно изменяется. Р-римость газа
в смешанном растворителе (содержащем малополярные компоненты) можно оценить по
соотношению:
обычно либо остается постоянной, либо незначительно изменяется. Р-римость газа
в смешанном растворителе (содержащем малополярные компоненты) можно оценить по
соотношению: 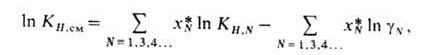
где
КН.си, КН.N-коэф. Генри соотв. для газа в смеси р-рителей и для р-ров этого
газа в чистых компонентах р-рителя;![]() -коэф.
активности компонентов р-рителя (молярные доли
-коэф.
активности компонентов р-рителя (молярные доли![]() относятся
к смеси р-рителей, свободной от растворенного газа).
относятся
к смеси р-рителей, свободной от растворенного газа).
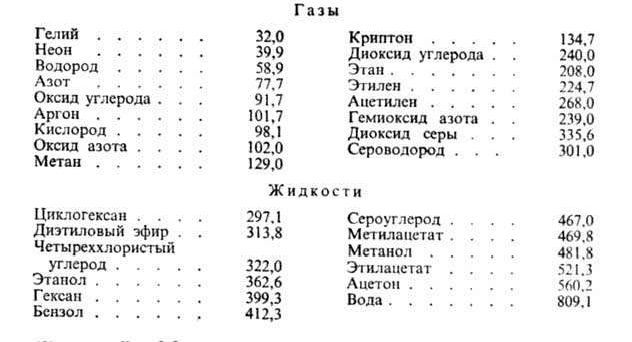
Нек-рые
данные о р-римости газов приведены в таблице, где газы и р-рители расположены в
порядке возрастания энергетич. параметров![]() и
и![]() потенциала Леннард-Джонса. Эти параметры м. б. использованы для приближенной
оценки р-римости газов при низких давлениях по ур-нию:
потенциала Леннард-Джонса. Эти параметры м. б. использованы для приближенной
оценки р-римости газов при низких давлениях по ур-нию:
![]()
где![]() -р-римость
в 1 м3 газа, приведенная к нормальным условиям (20 °С, 0,1 МПа) на 1 м3
абсорбента; kв- константа Больцмана; Р0, T0-соотв. давление и т-ра при
нормальных условиях; Р, Г-то же при рабочих условиях. Р-римость умеренно
растворимых газов в данном р-рителе возрастает линейно с увеличением
-р-римость
в 1 м3 газа, приведенная к нормальным условиям (20 °С, 0,1 МПа) на 1 м3
абсорбента; kв- константа Больцмана; Р0, T0-соотв. давление и т-ра при
нормальных условиях; Р, Г-то же при рабочих условиях. Р-римость умеренно
растворимых газов в данном р-рителе возрастает линейно с увеличением![]()
Ниже
приведены значения параметров потенциала Лен-нард-Джонса![]() (в К) для газов
(в К) для газов![]() и жидкостей
и жидкостей![]() :
:
Тепловой
эффект растворения газа АЯ линейно изменяется с увеличением![]() ; соотв. р-римость плохо р-римых газов
; соотв. р-римость плохо р-римых газов![]() , в основном Не, Ne, H2, N2, CO, Аr, О2 и NO, с возрастанием т-ры увеличивается
(за исключением водных р-ров), а р-римость хорошо р-римых газов
, в основном Не, Ne, H2, N2, CO, Аr, О2 и NO, с возрастанием т-ры увеличивается
(за исключением водных р-ров), а р-римость хорошо р-римых газов![]() уменьшается. Типичные примеры для бесконечно разбавленных р-ров приведены на
рис. 2. Р-римость таких газов, как H2S, COS, SO2, HC1, NH3, C12, обычно
значительно выше, чем рассчитанная по ур-нию (1), вследствие специфич. взаимод.
с молекулами р-рителя.
уменьшается. Типичные примеры для бесконечно разбавленных р-ров приведены на
рис. 2. Р-римость таких газов, как H2S, COS, SO2, HC1, NH3, C12, обычно
значительно выше, чем рассчитанная по ур-нию (1), вследствие специфич. взаимод.
с молекулами р-рителя.
При
хим. абсорбции поглотит. способность абсорбента (емкость, соответствующая
предельному кол-ву газа, к-рый поглощается единицей объема абсорбента) и![]() больше, чем при физ. абсорбция. При необратимой р-ции (напр., при поглощении
СО2 р-рами NaOH с образованием Na2CO3) равновесное давление газа над р-ром
равно нулю, пока в р-ре есть непрореагировавший абсорбент, и поглотит.
способность определяется стехиометрией р-ции. При обратимой р-ции давление газа
над р-ром равно нулю, но по сравнению с физ. абсорбцией резко изменяется
характер зависимости р-римости газа от давления (рис. 1, кривые 4,5). Так в
простейшем случае, когда в р-ре происходит только одна р-ция и активности
компонентов р-ра равны их концентрациям, имеем:
больше, чем при физ. абсорбция. При необратимой р-ции (напр., при поглощении
СО2 р-рами NaOH с образованием Na2CO3) равновесное давление газа над р-ром
равно нулю, пока в р-ре есть непрореагировавший абсорбент, и поглотит.
способность определяется стехиометрией р-ции. При обратимой р-ции давление газа
над р-ром равно нулю, но по сравнению с физ. абсорбцией резко изменяется
характер зависимости р-римости газа от давления (рис. 1, кривые 4,5). Так в
простейшем случае, когда в р-ре происходит только одна р-ция и активности
компонентов р-ра равны их концентрациям, имеем:
![]()
Рекомендуем скачать другие рефераты по теме: шпоры по психологии, ответы 11 класс.
1 2 3 4 | Следующая страница реферата