
Белки
Категория реферата: Биология и химия
Теги реферата: предмет культурологии, реферати українською
Добавил(а) на сайт: Головин.
1 2 3 | Следующая страница реферата
Белки
Белки (протеины), класс сложных азотсодержащих соединений, наиболее характерных и важных (наряду с нуклеиновыми кислотами) компонентов живого вещества. Белки выполняют многочисленные и разнообразные функции. Большинство белков – ферменты, катализирующие химические реакции. Многие гормоны, регулирующие физиологические процессы, тоже являются белками. Такие структурные белки, как коллаген и кератин, служат главными компонентами костной ткани, волос и ногтей. Сократительные белки мышц обладают способностью изменять свою длину, используя химическую энергию для выполнения механической работы. К белкам относятся антитела, которые связывают и нейтрализуют токсичные вещества. Некоторые белки, способные реагировать на внешние воздействия (свет, запах), служат в органах чувств рецепторами, воспринимающими раздражение. Многие белки, расположенные внутри клетки и на клеточной мембране, выполняют регуляторные функции.
В первой половине 19 в. многие химики, и среди них в первую очередь Ю.фон Либих, постепенно пришли к выводу, что белки представляют собой особый класс азотистых соединений. Название «протеины» (от греч. protos – первый) предложил в 1840 голландский химик Г.Мульдер.
Физические свойства
Белки в твердом состоянии белого цвета, а в растворе бесцветны, если только они не несут какой-нибудь хромофорной (окрашенной) группы, как, например, гемоглобин. Растворимость в воде у разных белков сильно варьирует. Она изменяется также в зависимости от рН и от концентрации солей в растворе, так что можно подобрать условия, при которых один какой-нибудь белок будет избирательно осаждаться в присутствии других белков. Этот метод «высаливания» широко используется для выделения и очистки белков. Очищенный белок часто выпадает в осадок из раствора в виде кристаллов.
В сравнении с другими соединениями молекулярная масса белков очень велика – от нескольких тысяч до многих миллионов дальтон. Поэтому при ультрацентрифугировании белки осаждаются, и притом с разной скоростью. Благодаря присутствию в молекулах белков положительно и отрицательно заряженных групп они движутся с разной скоростью и в электрическом поле. На этом основан электрофорез – метод, применяемый для выделения индивидуальных белков из сложных смесей. Очистку белков проводят и методом хроматографии.
Химические свойства
Строение. Белки – это полимеры, т.е. молекулы, построенные, как цепи, из повторяющихся мономерных звеньев, или субъединиц, роль которых играют у них -аминокислоты. Общая формула аминокислот
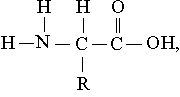
где R – атом водорода или какая-нибудь органическая группа.
Белковая молекула (полипептидная цепь) может состоять всего лишь из относительно небольшого числа аминокислот или из нескольких тысяч мономерных звеньев. Соединение аминокислот в цепи возможно потому, что у каждой из них имеются две разные химические группы: обладающая основными свойствами аминогруппа, NH2, и кислотная карбоксильная группа, СООН. Обе эти группы присоединены к -атому углерода. Карбоксильная группа одной аминокислоты может образовать амидную (пептидную) связь с аминогруппой другой аминокислоты:
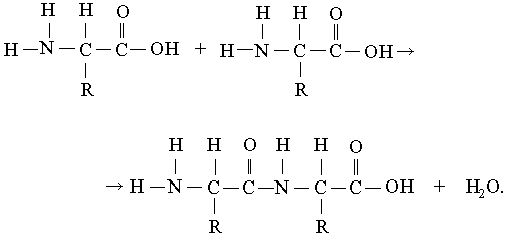
После того как две аминокислоты таким образом соединились, цепь может наращиваться путем добавления ко второй аминокислоте третьей и т.д. Как видно из приведенного выше уравнения, при образовании пептидной связи выделяется молекула воды. В присутствии кислот, щелочей или протеолитических ферментов реакция идет в обратном направлении: полипептидная цепь расщепляется на аминокислоты с присоединением воды. Такая реакция называется гидролизом. Гидролиз протекает спонтанно, а для соединения аминокислот в полипептидную цепь требуется энергия.
Карбоксильная группа и амидная группа (или сходная с ней имидная – в случае аминокислоты пролина) имеются у всех аминокислот, различия же между аминокислотами определяются природой той группы, или «боковой цепи», которая обозначена выше буквой R. Роль боковой цепи может играть и один атом водорода, как у аминокислоты глицина, и какая-нибудь объемистая группировка, как у гистидина и триптофана. Некоторые боковые цепи в химическом смысле инертны, тогда как другие обладают заметной реакционной способностью.
Синтезировать можно многие тысячи различных аминокислот, и множество различных аминокислот встречается в природе, но для синтеза белков используется только 20 видов аминокислот: аланин, аргинин, аспарагин, аспарагиновая кислота, валин, гистидин, глицин, глутамин, глутаминовая кислота, изолейцин, лейцин, лизин, метионин, пролин, серин, тирозин, треонин, триптофан, фенилаланин и цистеин (в белках цистеин может присутствовать в виде димера – цистина). Правда, в некоторых белках присутствуют и другие аминокислоты, помимо регулярно встречающихся двадцати, но они образуются в результате модификации какой-нибудь из двадцати перечисленных уже после того, как она включилась в белок.
Оптическая активность. У всех аминокислот, за исключением глицина, к -атому углерода присоединены четыре разные группы. С точки зрения геометрии, четыре разные группы могут быть присоединены двумя способами, и соответственно есть две возможные конфигурации, или два изомера, относящиеся друг к другу, как предмет к своему зеркальному отражению, т.е. как левая рука к правой. Одну конфигурацию называют левой, или левовращающей (L), а другую – правой, или правовращающей (D), поскольку два таких изомера различаются направлением вращения плоскости поляризованного света. В белках встречаются только L-аминокислоты (исключение составляет глицин; он может быть представлен лишь одной формой, поскольку у него две из четырех групп одинаковы), и все они обладают оптической активностью (поскольку имеется только один изомер). D-аминокислоты в природе редки; они встречаются в некоторых антибиотиках и клеточной оболочке бактерий.
Последовательность аминокислот. Аминокислоты в полипептидной цепи располагаются не случайным образом, а в определенном фиксированном порядке, и именно этот порядок определяет функции и свойства белка. Варьируя порядок расположения 20 видов аминокислот, можно получить огромное число разных белков, точно так же, как из букв алфавита можно составить множество разных текстов.
В прошлом на определение аминокислотной последовательности какого-нибудь белка уходило нередко несколько лет. Прямое определение и теперь достаточно трудоемкое дело, хотя созданы приборы, позволяющие вести его автоматически. Обычно проще бывает определить нуклеотидную последовательность соответствующего гена и вывести из нее аминокислотную последовательность белка. К настоящему времени уже определены аминокислотные последовательности многих сотен белков. Функции расшифрованных белков, как правило, известны, и это помогает представить себе возможные функции сходных белков, образующихся, например, при злокачественных новообразованиях.
Сложные белки. Белки, состоящие из одних только аминокислот, называют простыми. Часто, однако, к полипептидной цепи бывают присоединены атом металла или какое-нибудь химическое соединение, не являющееся аминокислотой. Такие белки называются сложными. Примером может служить гемоглобин: он содержит железопорфирин, который определяет его красный цвет и позволяет ему играть роль переносчика кислорода.
В названиях большинства сложных белков содержится указание на природу присоединенных групп: в гликопротеинах присутствуют сахара, в липопротеинах – жиры. Если от присоединенной группы зависит каталитическая активность фермента, то ее называют простетической группой. Нередко какой-нибудь витамин играет роль простетической группы или входит в ее состав. Витамин А, например, присоединенный к одному из белков сетчатки, определяет ее чувствительность к свету.
Третичная структура. Важна не столько сама аминокислотная последовательность белка (первичная структура), сколько способ ее укладки в пространстве. По всей длине полипептидной цепи ионы водорода образуют регулярные водородные связи, которые придают ей форму спирали либо слоя (вторичная структура). Из комбинации таких спиралей и слоев возникает компактная форма следующего порядка – третичная структура белка. Вокруг связей, удерживающих мономерные звенья цепи, возможны повороты на небольшие углы. Поэтому с чисто геометрической точки зрения число возможных конфигураций для любой полипептидной цепи бесконечно велико. В действительности же каждый белок существует в норме только в одной конфигурации, определяемой его аминокислотной последовательностью. Структура эта не жесткая, она как бы «дышит» – колеблется вокруг некой средней конфигурации. Цепь складывается в такую конфигурацию, при которой свободная энергия (способность производить работу) минимальна, подобно тому как отпущенная пружина сжимается лишь до состояния, соответствующего минимуму свободной энергии. Нередко одна часть цепи бывает жестко сцеплена с другой дисульфидными (–S–S–) связями между двумя остатками цистеина. Отчасти именно поэтому цистеин среди аминокислот играет особо важную роль.
Сложность строения белков столь велика, что пока еще невозможно вычислить третичную структуру белка, если даже известна его аминокислотная последовательность. Но если удается получить кристаллы белка, то его третичную структуру можно определить по дифракции рентгеновских лучей.
У структурных, сократительных и некоторых других белков цепи вытянуты и несколько лежащих рядом слегка свернутых цепей образуют фибриллы; фибриллы, в свою очередь, складываются в более крупные образования – волокна. Однако большинство белков в растворе имеет глобулярную форму: цепи свернуты в глобуле, как пряжа в клубке. Свободная энергия при такой конфигурации минимальна, поскольку гидрофобные («отталкивающие воду») аминокислоты скрыты внутри глобулы, а гидрофильные («притягивающие воду») находятся на ее поверхности.
Многие белки – это комплексы из нескольких полипептидных цепей. Такое строение называется четвертичной структурой белка. Молекула гемоглобина, например, состоит из четырех субъединиц, каждая из которых представляет собой глобулярный белок.
Структурные белки благодаря своей линейной конфигурации образуют волокна, у которых предел прочности на разрыв очень высок, глобулярная же конфигурация позволяет белкам вступать в специфические взаимодействия с другими соединениями. На поверхности глобулы при правильной укладке цепей возникают определенной формы полости, в которых размещены реакционноспособные химические группы. Если данный белок – фермент, то другая, обычно меньшая, молекула какого-то вещества входит в такую полость подобно тому, как ключ входит в замок; при этом меняется конфигурация электронного облака молекулы под влиянием находящихся в полости химических групп, и это вынуждает ее определенным образом реагировать. Таким способом фермент катализирует реакцию. В молекулах антител тоже имеются полости, в которых различные чужеродные вещества связываются и тем самым обезвреживаются. Модель «ключа и замка», объясняющая взаимодействие белков с другими соединениями, позволяет понять специфичность ферментов и антител, т.е. их способность реагировать только с определенными соединениями.
Белки у разных видов организмов. Белки, выполняющие одну и ту же функцию у разных видов растений и животных и потому носящие одно и то же название, имеют и сходную конфигурацию. Они, однако, несколько различаются по своей аминокислотной последовательности. По мере того как виды дивергируют от общего предка, некоторые аминокислоты в определенных положениях замещаются в результате мутаций другими. Вредные мутации, являющиеся причиной наследственных болезней, выбраковываются естественным отбором, но полезные или по крайней мере нейтральные могут сохраняться. Чем ближе друг к другу два каких-нибудь биологических вида, тем меньше различий обнаруживается в их белках.
Рекомендуем скачать другие рефераты по теме: скачать шпоры по праву, quality assurance design patterns системный анализ.
1 2 3 | Следующая страница реферата