
Электродные потенциалы. Электродвижущие силы
Категория реферата: Биология и химия
Теги реферата: чс реферат, реферат по химии
Добавил(а) на сайт: Agita.
Предыдущая страница реферата | 1 2 3 4 | Следующая страница реферата
Выделяя из этого ряда окислительно-восстановительные системы типа Меn+/Me и располагая их в порядке возрастания стандартных электродных потенциалов, получают электрохимический ряд напряжений металлов: Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H2, Bi, Cu, Hg, Ag, Pd, Pt, Au.
Электрохимический ряд напряжений характеризует свойства металлов в водных растворах:
чем меньше электродный потенциал металла, тем легче он окисляется и труднее восстанавливается из своих ионов;
металлы, имеющие отрицательные электродные потенциалы, т.е. стоящие в ряду напряжений левее водорода, способны вытеснять его из разбавленных растворов кислот;
каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые имеют более высокий электродный потенциал.
При
условиях, отличающихся от стандартных, численное значение равновесного
электродного потенциала для окислительно-восстановительной системы, записанной
в форме ![]() , определяется
по уравнению Нернста:
, определяется
по уравнению Нернста:
 (9.4)
(9.4)
где
![]() и
и ![]() - соответственно электродный и стандартный
потенциалы системы; R – универсальная газовая постоянная; Т – абсолютная
температура; F – постоянная Фарадея; n – число электронов, участвующих в
окислительно-восстановительном процессе.
- соответственно электродный и стандартный
потенциалы системы; R – универсальная газовая постоянная; Т – абсолютная
температура; F – постоянная Фарадея; n – число электронов, участвующих в
окислительно-восстановительном процессе.
С(Red) и C(Ox) – молярные концентрации соответственно восстановленной и окисленной форм соединения.
 , когда C(Red) = C(Ox) = 1.
, когда C(Red) = C(Ox) = 1.
При подстановке численных значений R = 8,314 Дж/(моль×К), F=96494 Кл и Т (298 К) и замене натуральных логарифмов на десятичные уравнение упрощается:
 . (9.5)
. (9.5)
Например, для окислительно-восстановительной системы
![]()
уравнение Нернста имеет вид
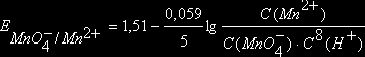 .
.
Ячейка для измерения электродного потенциала, например элемент Якоби-Даниэля, представляет собой пример электрохимического (гальванического) элемента – устройства, в котором химическая энергия окислительно-восстановительной реакции непосредственно преобразуется в электрический ток. Их называют также химическими источниками электрической энергии (ХИЭЭ).
Гальванический
элемент состоит из двух полуэлементов (окислительно-восстановительных систем), соединенных между собой металлическим проводником и солевым мостиком. На каждом
полуэлементе (часто называемом электродом) происходит полуреакция (электродный
процесс). Процесс окисления (отдача электронов) осуществляется на аноде
(отрицательный полюс), а восстановления (прием электронов) – на катоде
(положительный полюс). Например, в представленном гальваническом элементе
анодом является цинковый электрод: ![]()
а катодом – водородный или медный электрод:
2Н+
+ 2![]() Н2
Н2
![]()
![]() .
.
Электроны от анода по внешней цели протекают к катоду. Соответствующая схема такого гальванического элемента записывается следующим образом:
![]() - водородный катод;
- водородный катод;
(-) Zn½Zn2+
êê![]() - медный
катод.
- медный
катод.
На схеме одна вертикальная линия изображает границу раздела фаз (элетрод-раствор), а две вертикальные линии – границу между растворами (на практике она обычно обеспечивается с помощью солевого мостика – U-образной трубки с раствором электролита, необходимого для замыкания цели между двумя электродами).
Рекомендуем скачать другие рефераты по теме: 6 решебник виленкин, культурология.
Предыдущая страница реферата | 1 2 3 4 | Следующая страница реферата