
Электрохимические методы защиты металлов от коррозии
Категория реферата: Биология и химия
Теги реферата: база рефератов, реферат влияние
Добавил(а) на сайт: Хабенский.
Предыдущая страница реферата | 1 2 3 4 5 6 | Следующая страница реферата
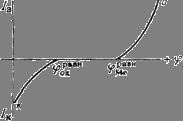
Рис. 3. Поляризационные кривые, отвечающие случаю, когда ![]() ; при этом
; при этом ![]() и коррозия металла
данным окислителем невозможна.
и коррозия металла
данным окислителем невозможна.
Легко понять, что при данном ![]() скорость коррозии может быть различной, если поляризационные
кривые а и к идут с различными наклонами. Та кривая, которая отвечает более высокому перенапряжению (идет более полого), будет определять в
основном скорость процесса. Так, при большом перенапряжении реакции (2) получим случай так называемого катодного контроля, когда кинетика определяется
скоростью катодной реакции; при этом
скорость коррозии может быть различной, если поляризационные
кривые а и к идут с различными наклонами. Та кривая, которая отвечает более высокому перенапряжению (идет более полого), будет определять в
основном скорость процесса. Так, при большом перенапряжении реакции (2) получим случай так называемого катодного контроля, когда кинетика определяется
скоростью катодной реакции; при этом ![]() близок к
близок к ![]() . При большом перенапряжении реакции (1) получим анодный контроль; при этом
. При большом перенапряжении реакции (1) получим анодный контроль; при этом ![]() близок к
близок к ![]() (рис.3).
(рис.3).
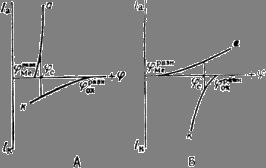
Рис. 4. Коррозионные диаграммы, отвечающие катодному контролю (А) и анодному контролю (Б).
Рассматривая рис.1 и 3, мы видим, что окислитель, восстанавливаясь, заставляет потенциал
металла сдвинуться от равновесного в сторону более положительных значений. Можно, сказать, что металл поляризован окислителем, если под поляризацией
понимать навязывание электроду потенциала, отличного от равновесного. И не совсем понятно, почему в современной литературе, особенно коррозионной, окислитель часто называют деполяризатором. Так, коррозию в кислотах, когда металл окисляется ионами Н+, навязывающими ему потенциал более
положительный, чем равновесный, называют «коррозией с водородной деполяризацией», коррозию при окислении металла кислородом – «коррозией с
водородной деполяризацией». Мы останавливаемся на этом мелком вопросе потому, что название «деполяризатор» вместо «окислитель» искажает химическую природу
явления. Окислитель поляризует металл, сообщая ему сверх равновесного потенциала некоторую величину ![]() , вызывающую окисление, а не снижает
, вызывающую окисление, а не снижает ![]() , т.е. не деполяризует металл.
, т.е. не деполяризует металл.
Применяемый в этой главе способ рассмотрения процессов коррозии при помощи поляризационных диаграмм весьма распространен. В том виде, в котором мы его использовали выше, он был предложен К. Вагнером и В. Траудом и подробно разработан А. М. Шультиным Способ этот характеризуется тем, что анодный и катодный токи, выражающие скорость противоположных по химическому смыслу процессов, откладываются в противоположные стороны от оси абсцисс. По оси абсцисс откладывается потенциал.
Однако весьма распространен и другой метод, предложенный Ю. Р. Эвансом, при котором ток, измеряющий скорость окисления и восстановления, откладывается в одном направлении и принимается за аргумент (абсцисса). Потенциал (ордината) откладывается так, что иногда вверх растет положительное значение, а иногда – отрицательное
Легко убедиться, что все способы изображения коррозионных диаграмм по существу равноценны. Дальше мы будем использовать различные способы изображения, для того чтобы научиться разбираться и в тех, и в других.
Методы защиты металлов от коррозии.В зависимости от характера коррозии и условий ее протекания применяются различные методы защиты. Выбор того или иного способа определяется его эффективностью в данном конкретном случае, а также экономической целесообразностью. Любой метод защиты изменяет ход коррозионного процесса, либо уменьшая скорость, либо прекращая его полностью. Коррозионные диаграммы, наиболее полно характеризующие коррозионный процесс, должны отражать и те изменения в ходе протекания, какие наблюдаются в условиях защиты. Коррозионные диаграммы можно использовать, поэтому при разработке возможных путей предохранения металлов от коррозии. Они служат основой для выяснения принципиальных особенностей того или иного метода. В связи с этим при рассмотрении существующих методов защиты поляризационные диаграммы будут использованы в их несколько упрощенном виде (4). На таких диаграммах постулируется линейная зависимость между плотностью и потенциалом каждой частной реакции. Это упрощение оказывается вполне допустимым при качественной оценке особенностей большинства методов
Эффективность защиты выражают через коэффициент торможения γ или степень защиты Z. Коэффициент торможения показывает, во сколько раз уменьшается скорость коррозии в результате применения данного способа защиты
![]()
где ![]() и
и ![]() - скорость коррозии до и после защиты. Степень защиты указывает, насколько полно удалось подавить коррозию благодаря применению этого метода:
- скорость коррозии до и после защиты. Степень защиты указывает, насколько полно удалось подавить коррозию благодаря применению этого метода:
![]()
или
![]()
Из всех методов защиты основанных на изменении электрохимических свойств металла под
действием поляризующего тока, наибольшее распространение получила защита металлов при наложении на них катодной поляризации (катодная защита). При
смещении потенциала металла в сторону более электроотрицательных значений (по сравнению с величиной стационарного потенциала коррозии) скорость катодной
реакции увеличивается, а скорость анодной падает (см. рис. 4). Если при стационарном потенциале ![]() соблюдалось равенство
соблюдалось равенство
![]() ,
,
то при более отрицательном значении ![]() это равенство нарушается:
это равенство нарушается:
![]()
причем
![]() .
.
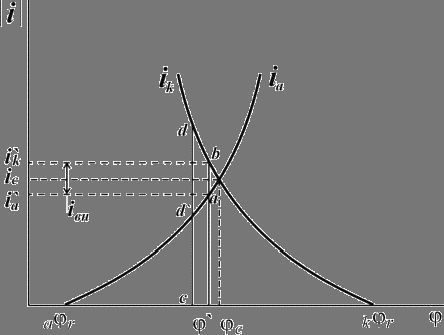
Рис. 5. Поляризационная диаграмма коррозионного процесса.
Уменьшение скорости анодной реакции при катодной поляризации эквивалентно уменьшению скорости коррозии. Коэффициент торможения при выбранном потенциале j/ (см.рис.4) будет равен двум
Рекомендуем скачать другие рефераты по теме: реферат на тему здоровье, мир докладов.
Предыдущая страница реферата | 1 2 3 4 5 6 | Следующая страница реферата