
Электролиз
Категория реферата: Биология и химия
Теги реферата: сочинение базаров, реферат по русскому языку
Добавил(а) на сайт: Манин.
Предыдущая страница реферата | 1 2 3 4 | Следующая страница реферата
![]()
![]()
![]()
![]()
![]()
![]()
![]() 2)
2) ![]()
![]()
![]() ( - ) Катод Анод ( + )
( - ) Катод Анод ( + )
4К+, 4Н2О SO42-, Н2О
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 3)
3) ![]()
( - ) Катод Анод ( + )
Zn2+, H2O SO42-, H2O
![]()
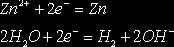
![]()
![]()
![]()
![]()
4) Электролиз водного раствора CuCl2 (активный медный анод)
![]()
![]()
![]()
![]()
![]() ( - ) Катод Анод ( + )
( - ) Катод Анод ( + )
Cu2+, H2O 2Cl-, H2O
![]()
![]()
![]()
![]()
![]()
Количественные характеристики электролитических процессов устанавливаются двумя законами Фарадея:
Масса веществ, выделившихся на электродах при электролизе, прямо пропорциональна количеству электричества, прошедшего через раствор или расплав электролита.
При пропускании одинакового количества электричества через растворы или расплавы различных элементов масса веществ, выделяющихся на электродах, пропорциональна молярным массам их эквивалентов.
Экспериментально установлено, что для выделения на электроде одной молярной массы эквивалента вещества необходимо затратить одно и то же количество электричества, равное ~96500 Кл. Оно получило название постоянной Фарадея F.
Рекомендуем скачать другие рефераты по теме: решебник 6 класс виленкин, бесплатные контрольные.
Предыдущая страница реферата | 1 2 3 4 | Следующая страница реферата