
Гены и генная терапия
Категория реферата: Биология и химия
Теги реферата: курсовая работа, рефераты по информатике бесплатно
Добавил(а) на сайт: Айвазовский.
Предыдущая страница реферата | 1 2
За последнее десятилетие за рубежом проведено большое количество клинических испытаний по противоопухолевой вакцинации. Так, в США за один только год (2003) прошло более 100 клинических исследований по вакцинотерапии опухолей. В основном их можно разделить на три группы. К первой относят клинические исследования, в которых в качестве иммуногенов используются известные опухолевые антигены в виде синтетических пептидов. Для этого определяется наличие этих антигенов в опухоли пациента и проводится иммунизация соответствующими пептидами. При подобном подходе частичный регресс опухоли достигался только в 2-3% случаев. С точки зрения клинической медицины применение стандартизованных химических пептидов имеет неоспоримое преимущество. Однако, во-первых, эффективность такой вакцинации незначительна, во-вторых, количество известных опухолевых антигенов еще очень ограничено. Кроме того, в организме пациентов уже сформировалась толерантность к опухолевым антигенам, используемым для вакцинации. Значит, необходимо каким-то образом либо преодолеть эту толерантность, либо применять те опухолевые антигены, на которые она еще не сформировалась.
Эти задачи пытаются решить в исследованиях, относящихся ко второй группе. Здесь источником опухолевых антигенов служат сами инактивированные опухолевые клетки, которые для преодоления толерантности генетически модифицируются, чтобы секретировать различные цитокины, такие как интерлейкин-2, -4, -7, интерферон, фактор, стимулирующий рост колоний, и целый ряд других. Все перечисленные цитокины принимают участие в формировании приобретенного иммунного ответа. Большинство опухолевых клеток, модифицированных для продукции определенных цитокинов, in vitro не замедляют свой рост. Однако in vivo рост опухоли значительно замедляется, что говорит об активации иммунного ответа организма благодаря цитокинам. Механизмы данного процесса до конца не ясны и могут отличаться для различных цитокинов. Тем не менее использование инактивированных цитокин-продуцирующих опухолевых клеток для иммунизации пациентов применяется в клинике, однако его эффективность составляет 3-4%.
К третьей группе относятся вакцины на основе дендритных клеток пациента, которые нагружаются вне организма (ex vivo) опухолевыми антигенами в виде пептидов или клеточных лизатов. Эффективность такой вакцинации, а именно случаи частичного регресса опухоли, составляет 7-7.5%.
Как видно из приведенных клинических данных, эффективность терапевтических вакцин достаточно низкая. Как это объяснить и как повысить их эффективность?
Для того чтобы разобраться со сложным процессом возможного противоопухолевого ответа, совершим небольшой экскурс в теорию иммунного ответа. В упрощенном виде иммунная система атакует то, что имеет признак “чужого” или/и не имеет признака “своего”. Эволюционируя, иммунная система должна была противостоять, в первую очередь, наружной инфекции, которая не имеет признаков “своего”, но несет признак “чужого”. Но трансформация собственных клеток организма и, как следствие, отсутствие признака “чужой”, а в то же время присутствие признака “свой”, приводит к возникновению толерантности в отношении переродившихся клеток. В данном случае мы даже не рассматриваем те опухоли, которые сами “научились” распознавать и атаковать клетки иммунной системы, например, через Fas лигандзависимый лизис. Таким образом, чтобы обеспечить эффективное распознавание опухолевых клеток, мы должны пометить их маркером “чужой”, а чтобы удалить их - активировать цитотоксический ответ.
Антиген-презентирующие клетки (АПК), к которым относятся дендритные клетки, макрофаги и некоторые другие, взаимодействуют с патогеном. Поглощенный патоген индуцирует синтез антигенных пептидов, которые представляются в комплексе с антигенами главного комплекса гистосовместимости (major histocomplatibility complex - MHC), формируя первый сигнальный каскад. Одновременно с этим АПК распознает “чужого”, запускает цитокиновый каскад и синтезирует костимуляторную (кооперативно действующую) молекулу В7, обеспечивая второй сигнальный каскад. Таким образом наивная Т-клетка превращается в обученную клетку-помощника. Через сложный каскад цитокинов и взаимодействий такая клетка инициирует антительный и/или цитотоксический Т-лимфоцитарный ответ (рис.2). Для надежности природой придуманы два сигнала, помогающие избежать ответа на “свои” антигены, который может привести к аутоиммунным заболеваниям. В случае злокачественной трансформации клеток организма именно отсутствие второго сигнала блокирует противоопухолевый ответ иммунной системы. Распознавание “чужого” происходит с помощью врожденной системы защиты организма.
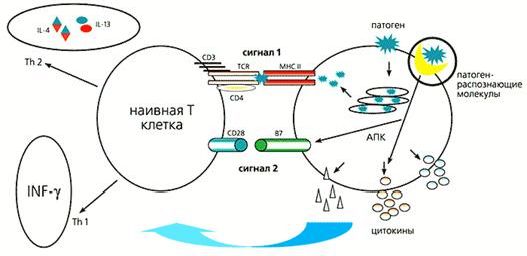
Рис.2. Схема взаимодействия антиген-презентирующей клетки (АПК) с Т-лимфоцитом, который еще никогда не встречался с патогенами. Для того, чтобы Т-лимфоциты научились распознавать патоген, необходимо образование Т-хелперов - лимфоцитов-помощников (Тh1, Th2). Это происходит лишь в случае получения двух сигналов: одного - через Т-клеточный рецептор (TCR) от главного комплекса гистосовместимости второго типа (МНСII), второго - благодаря взаимодействию костимуляторных молекул CD28 и В7. Первый сигнал обусловливает последующую направленность Т-лимфоцита на определенный антиген, а второй подтверждает чужеродность антигена. Т-лимфоциты узнают этот антиген на поверхности любой другой клетки организма, которую нужно уничтожить. Антиген-презентирующая клетка обеспечивает Т-лимфоцит обоими сигналами. Для синтеза В7 АПК должна посредством патоген-распознающих молекул узнать “чужое”. Одновременно с этим патоген поглощается антиген-презентирующей клеткой, а его антигенные пептиды транспортируются на поверхность АПК с молекулой MHCII. Весь этот контактный процесс дополнительно сопровождается секрецией определенных цитокинов.
Еще не так давно врожденная система защиты рассматривалась как некая примитивная система, обеспечивающая первичную защиту организма от инфекций. Теперь стало ясно, что она не столь примитивна, а должна сложным образом отличить “свое” от “чужого” и, более того, без ее правильного функционирования нет адекватного адаптивного ответа организма. В систему врожденного распознавания “чужого” и адекватного реагирования вовлечен целый ряд распознающих и сигнальных молекул. Наиболее хорошо изучено семейство TLR (Toll like receptors) млекопитающих.
Совсем недавно в нашей лаборатории, а позднее и зарубежными исследователями обнаружено новое семейство сигнальных и распознающих молекул. Мы назвали новое семейство Tag7 - по первому обнаруженному члену семейства, а зарубежные авторы - PGRP; они работали на стандартном объекте генетиков - плодовой мушке дрозофиле, а мы изучали функции представителей этого семейства у млекопитающих. Перечислять все выявленные функции этих молекул в рамках одной статьи не имеет смысла. Остановимся на найденных и оказавшихся существенными для дальнейшей работы по созданию противоопухолевой вакцины. Первое замечательное свойство секретируемого белка Tag7/PGRP состоит в том, что он привлекает к месту секреции (т.е. к клеткам, выделяющим белок в окружающую среду) клетки иммунной системы, в том числе и профессиональные антиген-презентирующие клетки. Второе его свойство, которое решили использовать при создании вакцины, - способность активировать созревание дендритных клеток, т.е. стимулировать экспрессию сигнальной молекулы В7, которая и обеспечивает последующее созревание наивного Т-лимфоцита.
Насколько эффективен тот или иной подход, какой механизм вовлечен в формирование противоопухолевого ответа, изучается на экспериментальных моделях, на животных. Мы использовали линии клеток мышиной меланомы, которые могут расти как в культуре (вне организма), так и после их введения животным. В культуре клетки наращивались до определенного количества, затем их генетически модифицировали вектором, содержащим ген tag7/PGRP. После этого опухолевые клетки начинали секретировать белок Tag7/PGRP, количество которого измерялось. Далее клетки облучали для подавления их деления, т.е. инактивировали, и вводили животным в качестве вакцины. Через 10 дней, после формирования иммунного ответа, в противоположную ногу животным вводили исходные (неинактивированные и немодифицированные) опухолевые клетки и в дальнейшем наблюдали за ними. Оказалось, что на иммунизированных таким образом животных опухоли практически не формировались или, появившись, вскоре исчезали, все животные при этом выживали. В контрольных группах животных опухоли развивались, и мыши погибали.
В других экспериментах мы использовали так называемых “голых” мышей - у них отсутствуют Т-лимфоциты. Считается, что именно эти клетки играют одну из основных ролей в элиминации опухолей. Животным, полностью лишенным Т-клеток, вакцинация не помогала, что говорило о том, что и в нашем случае Т-клетки чрезвычайно важны для противоопухолевого ответа. Последующие опыты показали, что в наблюдаемом нами противоопухолевом ответе организма определенное участие принимают и натуральные киллеры, и В-лимфоциты. Никаких побочных негативных явлений, вызванных вакцинацией, не отмечалось. Более трех лет в нашей лаборатории шли опыты на животных, а результаты публиковались в престижных международных журналах. В терапевтической схеме, т.е. когда сначала вводили опухолевые клетки и лишь потом вакцину, эффективность была меньше, но тем не менее большое количество животных выживало.
После успешных экспериментов на животных в 2000 г. решили начать клинические испытания. В этом нам очень помогли руководство и сотрудники РОНЦ им.Н.Н.Блохина РАМН в Москве и НИИ онкологии им.Н.Н.Петрова в Санкт-Петербурге. Составили Протокол проведения клинических испытаний. По действующим жестким правилам первые испытания новых способов лечения проводятся на пациентах, которым уже никакая другая терапия помочь не в состоянии; в данном случае на больных меланомой (одним из самых страшных видов рака), для которых методы лечения были исчерпаны.
Схема индивидуального приготовления вакцины выглядит следующим образом: из удаленной во время хирургической операции опухоли отбирается первичный опухолевый материал, и из него в лабораторных условиях получают первичную опухолевую клеточную линию. Далее эти клетки размножают и подбирают условия для их генетической модификации. После проведения самой генетической модификации, инактивации опухолевых клеток радиацией и определения уровня экспрессии гена вакцина готова. В 2001 г. вакцинировали первого пациента. К настоящему времени начальную фазу испытаний можно считать успешно завершенной. По результатам проведенных исследований написана и опубликована статья в международном журнале.
Каков краткий итог проведенных исследований? Нашим коллегам-клиницистам удалось добиться стабилизации заболевания в 25% случаев, а частичного регресса опухоли - в 7% случаев. Конечно, эти цифры не впечатляют, но если сравнить с выше приведенными данными, где эффективность похожего подхода составляла всего 3%, то использование активаторов врожденного компонента иммунной защиты (белка Tag7/PGRP) повысило положительную динамику в два раза. В то же время надо понимать, что с помощью вакцины практически нельзя удалить большую опухоль, тем более если пациент уже прошел курс химиотерапии и его иммунная система подавлена не только прогрессирующей опухолью, но и проводимой терапией. Какова же область применения аутологичной вакцины? Несомненно, она нужна после хирургического вмешательства, чтобы избежать рецидивов заболевания. Когда удален крупный опухолевый узел, возможный источник метастазов, эта вакцина способна уничтожить невидимые глазу врача единичные опухолевые клетки.
Зарубежные лаборатории и клиники уже накопили большой опыт подобных работ. В России же - это первое и пока единственное клиническое испытание вакцинотерапии опухолей с помощью аутологичных генетически модифицированных клеток. За это время нам пришлось преодолеть массу трудностей. Эффективность получения клеточной линии из опухолевого материала весьма низкая, порядка 10-15%. Реально приготовление вакцины занимает 3-5 мес и требует участия квалифицированных специалистов, которых в нашей стране практически не осталось. Кроме этого, для работы необходимы высококачественные импортные клеточные реагенты, специальное оборудование, абсолютная стерильность, а это существенно влияет на стоимость исследований. Клиническое исследование, проведенное нами, оказалось возможным только благодаря поддержке, получаемой от мэра г.Москвы Ю.М.Лужкова.
Несомненно, предложенный нами подход показал свою эффективность, но его можно и нужно улучшать. Во-первых, необходимо в будущей вакцине совместить активацию врожденного компонента и приобретенного иммунитета. В настоящее время в нашей лаборатории такие исследования проводятся. Во-вторых, сделать клиническое применение вакцины более удобным и менее дорогостоящим. Для этого имеются все предпосылки, поскольку в ходе клинических исследований сформировался банк опухолевых клеточных линий, охарактеризованных по многим параметрам. В настоящее время мы подбираем наиболее эффективные с точки зрения представленности опухолевых антигенов клеточные линии для приготовления аллогенной (не персональной) генетически модифицированной вакцины. Такой стандартный препарат, готовый к использованию, сократит и время от момента операции до начала его применения.
В заключение хочется подчеркнуть два важных момента. Для лечения онкологических заболеваний нельзя найти одно универсальное лекарство - слишком многообразны трансформированные (злокачественные) клетки. Именно поэтому мы разработали целый ряд генно-терапевтических подходов по блокированию кровеснабжения опухоли. Лишенная питания и кислорода опухолевая ткань должна погибнуть. Но даже и комбинация двух методов не станет панацеей. Необходимы дальнейшие исследования и испытания методов. При этом всегда надо помнить, что чудес не бывает.
Скачали данный реферат: Констанция, Вагин, Трапезников, Vagin, Шелепов, Автухов.
Последние просмотренные рефераты на тему: реферат капитал, диплом государственного образца, курсовик, реферат по истории.
Предыдущая страница реферата | 1 2