
Характеристики и свойства истинных растворов
Категория реферата: Биология и химия
Теги реферата: бесплатные рефераты скачать, оформление титульный реферата
Добавил(а) на сайт: Евстахий.
Предыдущая страница реферата | 1 2 3 4 | Следующая страница реферата

Эквивалент соли может быть вычислен как частное от деления ее молярной массы на произведение числа ионов металла и его валентности:
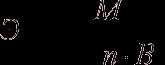
Пользуясь растворами, состав которых выражен нормальностью, легко рассчитать, в каких объемных отношениях они должны быть смешаны, чтобы растворенные вещества прореагировали без остатка. Пусть V1 раствора вещества 1 с нормальностью N1 реагирует с V2 раствора вещества 2 с нормальностью N2. Это означает, что в реакцию вступило N1V1 эквивалентов вещества 1 и N2V2 эквивалентов вещества 2. Но вещества реагируют в эквивалентных количествах, следовательно
N1V1 = N2V2 и
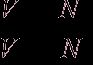
Т.е. объемы растворов реагирующих веществ обратно пропорциональны их нормальностям.
Первый закон Рауля
Над каждой жидкостью (растворителем или раствором) устанавливается определенное давление пара, насыщающего пространство. Это давление характеризует состояние равновесия между жидкой фазой и находящимися над нею молекулами растворителя.
Рассмотрим растворы нелетучих веществ, такие, над которыми давление пара обусловлено определенной концентрацией молекул растворителя, а концентрация молекул растворенного вещества практически равна нулю или имеет ничтожно малую величину, которой можно пренебречь. Давление пара над такими растворами меньше, чем давление пара над чистыми растворителями при той же температуре.
Поверхность раствора, в отличие от поверхности чистого растворителя, частично занята молекулами нелетучего растворенного вещества. Это приводит к уменьшению числа молекул растворителя, испаряющихся в единицу времени. Следует также учитывать силы сольватационного воздействия между молекулами растворителя и растворенного вещества, которые могут быть прочнее сил сцепления молекул растворителя друг с другом.
Таким образом, добавление к растворителю любого растворимого в нем нелетучего вещества и образование раствора вызывает нарушение состояния равновесия между растворителем и его насыщенным паром и установление нового равновесия, при котором давление пара раствора будет несколько меньше давления пара растворителя при той же температуре.
Если
обозначить давление пара растворителя через p0, давление пара раствора через p, то разность p0 – p = ![]() p показывает
величину понижения давления пара. Отношение этой разности к давлению пара
растворителя показывает относительное понижение давления пара растворителя
p показывает
величину понижения давления пара. Отношение этой разности к давлению пара
растворителя показывает относительное понижение давления пара растворителя
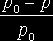 или
или ![]() .
.
Согласно Первому закону Рауля относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества:
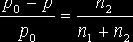 или
или  ,
,
где n2 и n1 – количества растворенного вещества и растворителя, соответственно.
После некоторых преобразований закон Рауля можно записать и таком виде:
![]() и
и ![]() .
.
Второй закон Рауля
Наряду с понижением давления пара изменяются также температуры кипения и замерзания указанных растворов. Растворы кипят при более высокой температуре, а замерзают – при более низкой, по сравнению с соответствующими температурами для чистого растворителя.
При кипении давление пара жидкости становится равным внешнему давлению. Из-за понижения давления пара раствора его надо нагреть до более высокой температуры, чем растворитель, чтобы давление его пара достигло внешнего давления и раствор мог закипеть.
Для выделения кристаллов льда из раствора последний должен быть охлажден до некоторой температуры, лежащей ниже температуры замерзания воды.
Таким образом, при растворении в воде вещества пределы жидкого состояния раствора расширены по сравнению с растворителем на число градусов, равное сумме повышения температуры кипения раствора Dtкип. и понижения его температуры замерзания Dtзам.. Значения величин Dtкип. и Dtзам пропорциональны моляльности раствора. Одномоляльные растворы различных веществ (неэлектролитов) характеризуются определенной для данного растворителя величиной повышения температуры кипения и, соответственно, понижения температуры замерзания.
Повышение температуры кипения одномоляльного раствора называется эбулиоскопической постоянной растворителя Екип, а понижение температуры замерзания – криоскопической постоянной растворителя Езам. Таким образом, в соответствии со вторым законом Рауля повышение температуры кипения или понижение температуры замерзания разбавленных растворов неэлектролитов пропорциональны числу частиц растворенного вещества и не зависят от его природы:
Dtкип = Екип · m,
Dtзам = Езам · m;
Рекомендуем скачать другие рефераты по теме: курсовые, мировая экономика.
Предыдущая страница реферата | 1 2 3 4 | Следующая страница реферата