Кинетическое и термодинамическое исследование физико-химических процессов
Категория реферата: Биология и химия
Теги реферата: банк рефератов, конспекты бесплатно
Добавил(а) на сайт: Валентина.
Предыдущая страница реферата | 1 2 3 4
2.1. Термодинамический вывод диаграммы состояния системы с простой эвтектикой
Рассмотрим изотермы удельных изобарных потенциалов расплавов двойной системы В—А для разных температур. Установим, какие фазы находятся в равновесии при той или иной температуре, и построим диаграмму зависимости температур от состава системы, т. е. диаграмму состояния.
На рис.I изображены изотермические диаграммы удельного изобарного потенциала этой системы в жидком состоянии для температур t1 › t2 › t3 › t4 › t5 › t6 (диаграммы I—VI; VII — полученная из них диаграмма состояния). Точками Аs и Вs на всех диаграммах обозначены удельные изобарные потенциалы компонентов в твердом состоянии. Точки Al и Bl (концевые точки кривых) относятся к тем же компонентам в жидком состоянии.
Пусть температура t1 выше температуры плавления более высокоплавкого компонента А. При этой температуре точки Аs и Вs лежат соответственно выше точек Al и Bl (диаграмма I). Следовательно, смеси всех составов при температуре t1 будут в жидком состояни. При понижении температуры изобарный потенциал возрастает, так как dG/dT =-S, где S — энтропия, величина всегда положительная. Энтропия одного и того же вещества в жидком состоянии больше, чем в твердом при той же температуре, поэтому с понижением температуры изобарный потенциал жидкости возрастает быстрее, чем твердого тела. Вследствие этого при более низких температурах устойчиво твердое вещество. Эти различия в температурном ходе изобарного потенциала твердых и жидких веществ обусловливают и вывод диаграммы с начала кристаллизации расплавов, для которого важно относительное движение точек Аs (Вs) и Al (Bl). При понижении температуры точка Аs, сближается с точкой Al, а точка Вs — с Bl, и при температуре плавления компонента А (t2) точки Аs и Al совпадают, точка же Вs лежит пока еще выше Bl, и при температуре t2 компонент В находится в расплавленном состоянии (диаграмма II).
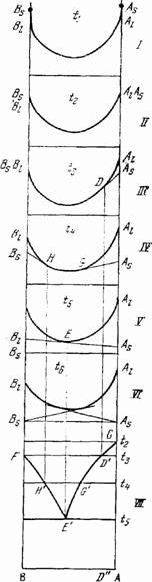
Рис.1. Вывод диаграммы состояния двойной системы с простой эвтектикой из изотермы изобарного потенциала.
Диаграмма III соответствует t3 - температуре плавления компонента В; точки Вs, и Bl; совпадают. Точка Аs находится ниже Al. Проведем из точки Аs касательную к кривой и через точку касания D — вертикальную линию. Отметим на диаграмме состояния (диаграмма VII) температуру t3 и проведем соответствующую ей изотермическую прямую F t3. Точка пересечения прямой F t3 с указанной выше вертикальной прямой (точка D') указывает температуру начала затвердевания системы с составом, изображаемым точкой D. Кроме того, отметим на диаграмме точки плавления компонентов А и В (точки С и F).
При дальнейшем понижении температуры до t4 (диаграмма IV), которая немного ниже температуры плавления более низкоплавкого компонента В, обе точки Аs и Вs, по сравнению с Al и Bl окажутся еще ниже, чем при температуре t3. Из этих точек можно провести касательные к кривой, причем точки касания G и Н дают составы растворов, находящихся при этой температуре в равновесии с твердым А и соответственно с твердым В. Точка G, как легко видеть, будет лежать левее, чем точка D диаграммы VII. Пользуясь диаграммой VII, получим соответствующие точки Н' и С' на диаграмме состояния при помощи описанного выше приема. При продолжающемся падении температуры точки Аs и Вs будут претерпевать дальнейшее понижение относительно Al и Bl, вследствие чего точки касания G и Н будут двигаться навстречу друг другу (первая налево, а вторая направо). Наконец, при температуре t5 (диаграмма V), когда обе точки касания встретятся в точке Е, обе касательные сольются в одну прямую. Это означает, что при этой температуре оба твердых компонента находятся в равновесии с одним и тем же раствором, состав которого дается точкой Е. Перенесем уже описанным способом точку Е на диаграмму состояния и получим точку Е'.
Если соединить точки, полученные указанным выше способом на диаграммеме VII, то получим две линии температур начала затвердевания: FН'Е’, отвечающую выделению компонента В, и CD’G'Е', отвечающую выделению компонента А. Таким образом, кривая температур начала кристаллизации диаграммы состояния окажется построенной. Эта кривая называется ликвидусом и состоит из двух ветвей, соответствующих кристаллизации того и другого компонента. Ветви пересекаются в точке Е', которая будет изображать состояние раствора (расплава), находящегося в равновесии одновременно с твердыми В и А. Раствор, находящийся в равновесии с двумя твердыми фазами, называется двояконасыщенным. При продолжающемся отнятии теплоты от системы температура и состав жидкости, состояние которой определяется течкой Е', постоянны. Расплав Е' называется эвтектическим или жидкой эвтектикой. Затвердевшая жидкая эвтектика называется твердой эвтектикой ( по валовому составу они тождественны), а температура, при которой такая эвтектика затвердевает,— эвтектической температурой. Точка Е' изображающая состояние жидкой эвтектики (фигуративная точка жидкой эвтектики), называется эвтектической точкой. Когда это не может повести к недоразумению, употребляют один термин — эвтектика, объединяя и температуру, и состав эвтектической точки. Так как в эвтектике двойной системы число компонентов равно двум, число фаз — трем, а давление постоянно, то эта точка нонвариантная (точнее, условно-нонвариантная).
Вернемся к рис.1. При дальнейшем понижении температуры (диаграмма VI) точки Аs и Вs и соединяющая их прямая еще более опустятся по отношению к кривой. Из этих точек можно, конечно, провести касательные к кривой и определить, таким образом, растворы, находящиеся в равновесии с твердыми А и В. Однако эти равновесия отвечают неустойчивым состояниям, что соответствует возможности продолжить кривую плавкости за эвтектическую точку. В устойчивых же состояниях будут находиться механические смеси твердых А и В, так как при данном составе удельный изобарный потенциал смеси будет меньше, чем смеси твердых А или В с находящимися с ними в равновесии растворами.
Список литературы
К.Б. Яцимирский ″Кинетические методы анализа″, М.:″ Химия″ 1967г
В.Я. Аносов, М.И. Озерова, Ю.Я. Фиалков ″Основы физико-химического анализа″, М.: ″Наука″,1976
Скачали данный реферат: Агриппина, Куделин, Шаньгин, Nosatenko, Solov'jov, Torsunov.
Последние просмотренные рефераты на тему: политика реферат, физика и техника, конституция реферат, bestreferat ru.
Предыдущая страница реферата | 1 2 3 4