
Медь и её природные соединения, синтез малахита
Категория реферата: Биология и химия
Теги реферата: гражданское право реферат, реферат на тему информация
Добавил(а) на сайт: Kabinov.
Предыдущая страница реферата | 1 2 3 4 5 6 7 | Следующая страница реферата
Асбестовая сетка – 1.
Стеклянная палочка – 2.
Воронка Бюхнера – 1.
Колба Бунзана – 1.
Фильтровальная бумага.
Вакуумный насос.
Пробирка.
Горелка.
2)Расчёт и материальный баланс.
![]() (мал)
=
(мал)
=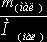 =
=![]() =0.022 моль
=0.022 моль
![]() (CuSO4)
=2 ·
(CuSO4)
=2 · ![]() (мал) =0.044 моль
(мал) =0.044 моль
м(CuSO4)
= ![]() (CuSO4)
· М(CuSO4) = 0,044 - 250 = 11 г.
(CuSO4)
· М(CuSO4) = 0,044 - 250 = 11 г.
![]() (NaHCO3)
= 4 ·
(NaHCO3)
= 4 · ![]() (мал)
= 4 · 0,022 = 0,088 моль
(мал)
= 4 · 0,022 = 0,088 моль
м
(NaHCO3) = ![]() (NaHCO3)
· М (NaHCO3) = 0,088 · 84 = 7,39 г.
(NaHCO3)
· М (NaHCO3) = 0,088 · 84 = 7,39 г.
м (NaHCO3) = 7,39 · 0,739 = 8,13 г.
Ход работы.
В фарфоровой ступке смешали 11 г. тонко стёртой сухой соли CuSO4 ·5H2O с гидрокарбонатом натрия 8,13 г.
В стакане нагрели до кипения 200 мл. воды. Смесь высыпали небольшими порциями в кипящую воду, быстро перемешивая. При этом наблюдается вспенивание. Следующую порцию смеси вносили после прекращения вспенивания. Содержимое стакана кипятили 10-15 мин для удаления из раствора СО2. В результате реакции образуются гидроксокарбонат меди:
![]() 2CuSO4 + 4NaHCO3 = CuCО3·Cu(OH)2 + 2Na2SO4+3CO2 + H2O
2CuSO4 + 4NaHCO3 = CuCО3·Cu(OH)2 + 2Na2SO4+3CO2 + H2O
Осадку давали отстояться, затем промывали декантацией горячей водой, отмывая от иона SO42-; делали пробу на полноту промывания (4 раза). Основную соль отсасывали на воронке Бюхнера и сушили между листьями фильтровальной бумаги, а затем высушивали в эксикаторе при комнатной температуре.
Вывод.
Получили заданное вещество, научились пользоваться вспомогательной литературой.
Практический выход – 94%
![]()
Рекомендуем скачать другие рефераты по теме: древний египет реферат, решебник по английскому.
Предыдущая страница реферата | 1 2 3 4 5 6 7 | Следующая страница реферата