
Реальные газы
Категория реферата: Биология и химия
Теги реферата: bestreferat, доклад по химии
Добавил(а) на сайт: Деменок.
1 2 3 4 5 | Следующая страница реферата
Реальные газы
Курсовая работа выполнил: студент 462 группы Махорт Александр
ГОУ ВПО Тюменский государственный университет
Тюмень, 2007.
Понятие реального газа. Его свойства.
Газы (французское gaz; название предложено голланским учёным Я. Б. Гельмонтом), агрегатное состояние вещества, в котором его частицы не связаны или весьма слабо связаны силами взаимодействия и движутся свободно, заполняя весь предоставленный им объём. Вещество в газообразном состоянии широко распространено в природе. Газы образуют атмосферу Земли, в значительных количествах содержатся в твёрдых земных породах, растворены в воде океанов, морей и рек. Солнце, звёзды, облака межзвёздного вещества состоят из газов — нейтральных или ионизованных (плазмы). Встречающиеся в природных условиях газы представляют собой, как правило, смеси химически индивидуальных газов.
Газы обладают рядом характерных свойств. Они полностью заполняют сосуд, в котором находятся, и принимают его форму. В отличие от твёрдых тел и жидкостей, объём газа существенно зависит от давления и температуры. Коэффициент объёмного расширения газа в обычных условиях (0-100°С) на два порядка выше, чем у жидкостей, и составляет в среднем 0,003663 град-1.
Модель идеального газа, используемая в молекулярно-кинетической теории газов, позволяющая описывать поведение разрежённых реальных газов при достаточно высоких температурах и низких давлениях. При выводе уравнения состояния идеального газа размерами молекул и их взаимодействием друг с другом пренебрегают. Повышение давления приводит к уменьшению среднего расстояния между молекулами, поэтому необходимо учитывать объём молекул и взаимодействие между ними. При высоких давлениях и низких температурах указанная модель идеального газа непригодна.
Неидеальность газов в молекулярно-кинетической теории рассматривается как результат взаимодействия молекул. В первом приближении ограничиваются рассмотрением парных взаимодействий, во втором-тройных и т.д. Такой подход приводит к вириалъному уравнению состояния, коэффициенты которого могут быть теоретически рассчитаны, если известен потенциал межмолекулярных взаимодействий. Наиболее полезно вириальное уравнение при рассмотрении свойств газов малой и умеренной плотности. Этот вопрос будет раскрыт немного позже.
Наличие межмолекулярных взаимодействий оказывает влияние на все свойства реальных газов, в т.ч. приводит и к тому, что их внутренняя энергия зависит от плотности. С этим свойством связан эффект Джоуля-Томпсона: изменение температуры газа при его адиабатическом расширении, напр. при протекании с малой постоянной скоростью через пористую перегородку (этот процесс называется дросселированием). Учет межмолекулярных взаимодействий и внутреннего строения молекул необходим при решении многих теоретических задач физики и физической химии. Молекул, которые можно было бы принимать как упругие шары, практически не бывает, и при расчете свойств реальных газов применяют другие молекулярные модели. Из них наиболее употребительны простые модели гармонического осциллятора и жесткого ротатора.
Реальные газы при незначительных плотностях имеют свойства, отличающиеся от свойств идеальных газов. Это различие свойств тем значительнее, чем выше плотность газа. Так, например, из уравнения Менделеева-Клайперона следует, что так называемый коэффициент сжимаемости для любого газа Zсж = pV/RT = 1. В действительности же коэффициент сжимаемости является переменной величиной, принимающей в зависимости от давления и температуры значения и большие, и меньшие единицы, и только при малых давлениях он равен единице. (см. рис 6.1)
Внутреннее строение молекул газа слабо влияет на их термические свойства (давление, температуру, плотность и связь между ними). Для этих свойств в первом приближении существенна только молекулярная масса реального газа. Напротив, его калорические свойства (теплоёмкость, энтропия и др.), а также его электрические и магнитные свойства существенно зависят от внутреннего строения молекул. Например, для расчёта (в первом приближении) теплоёмкости при постоянном объёме - Cv необходимо знать число внутренних степеней свободы молекулы (т. е. число возможных внутренних движений). В соответствии с законом равнораспределения классической статистической физики на каждую степень свободы молекулы газа (поступательную, колебательную, вращательную) приходится энергия, равная 1/2 · kT. Отсюда теплоёмкость 1 моля равна:
![]()
Отступление свойств реальных газов от свойств идеальных газов обнаруживается не только при изучении сжимаемости газов, но также при изучении калорических свойств газов, например их теплоемкостей. Теплоемкости Cv и Cp идеального газа не зависят от давления (или объема ) и являются функциями только температуры . В действительности теплоемкости всех газов зависят от давления или объема.
Для точного расчёта калорических свойств газа необходимо знать уровни энергии молекулы, сведения о которых в большинстве случаев получают из анализа спектров. Для большого числа веществ в состоянии идеального газа калорические свойства вычислены с высокой точностью и их значения представлены в виде таблиц до температур 10—22 тыс. градусов.
Электрические свойства газов связаны в первую очередь с возможностью ионизации молекул или атомов, т. е. с появлением в них электрически заряженных частиц (ионов и электронов). При отсутствии заряженных частиц газы являются хорошими диэлектриками. С ростом концентрации зарядов электропроводность увеличивается.
При температурах, начиная с нескольких тысяч градусов всякий газ частично ионизуется и превращается в плазму. Если концентрация зарядов в плазме невелика, то свойства её мало отличаются от свойств обычного газа.
По магнитным свойствам газы делятся на диамагнитные (к ним относятся, например, инертные газы, H2, N2, CO2, H2O) и парамагнитные (например, O2). Диамагнитны те газы, молекулы которых не имеют постоянного магнитного момента и приобретают его лишь под влиянием внешнего поля. Те же, у которых молекулы обладают постоянным магнитным моментом, во внешнем магнитном поле ведут себя как парамагнетики. Учёт межмолекулярного взаимодействия и внутреннего строения молекул необходим при решении многих проблем физики Г., например при исследовании влияния верхних разреженных слоев атмосферы на движение ракет и спутников.
Применение законов классичесской статистики с учетом квантовых закономерностей позволяет рассчитать по молекулярным данным термодинамические функции газа (энтропию, внутреннюю энергию, энергии Гельмгольца и Гиббса), константы химического равновесия газофазных реакций, теплоемкость и кинетические характеристики, знание которых требуется при проектировании многих технологических процессов. Так, теплоемкость идеального газа может быть рассчитана в классической теории, если известно число i степеней свободы молекулы. Вклад каждой из вра-щат. и постулат, степеней свободы молекулы в молярную теплоемкость Суд равен R/2, а каждой из колебательных степеней свободы-JR (т. наз. закон равнораспределения). Частица одноатомного газа обладает тремя степенями свободы, соотв. его теплоемкость составляет ЗЯ/2, что хорошо совпадает с экспериментальными данными. Молекула двухатомного газа обладает тремя поступательными, двумя вращательными и одной колебательной степенями свободы, и, согласно закону равнораспределения, Суд = 1R/2, однако это значение не совпадает с опытными данными даже при обычных температурах. Наблюдаемое расхождение, а также температурная зависимость теплоемкости газа объясняются квантовой теорией.
Внутренняя энергия реальных газов.
Внутренняя энергия реального газа складывается из кинетической энергии теплового движения его молекул и из потенциальной энергии межмолекулярного взаимодействия. Потенциальная энергия реального газа обусловлена только силами притяжения между молекулами. Наличие сил притяжения приводит к возникновению внутреннего давления на газ.
р΄=а/V2
![]()
Работа, которая затрачивается для преодоления сил притяжения, действующих между молекулами газа, или, иными словами, против внутреннего давления, как известно из механики, идёт на увеличение потенциальной энергии системы.
Т.е. dA=p΄Vm=dП, или dП=a/V2m*dVm, откуда П=-а/Vm.
Знак минус означает, что молекулярные силы, создающие внутреннее давление р΄, являются силами притяжения. Если газ расширяется без теплообмена с окружающей средой и не совершает внешней работы, то на основании первого начала термодинамики получим, что U1=U2. Следовательно, при адиабатическом расширении без совершения внешней работы внутренняя энергия газа не изменяется.
Использование выражения для внутренней энергии идеального газа позволяет записать формулу, для расчета внутренней энергии газа Ван-дер-Ваальса в виде:
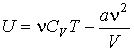
Как следует из этого выражения, внутренняя энергия газа Ван-дер-Ваальса зависит не только от его температуры, как в случае с идеальным газом, но и от объема, занимаемого им. По этой причине, при осуществлении изотермических процессов в газе Ван-дер-Ваальса, будет изменяться его внутренняя энергия, а, следовательно, при таких процессах подведенная к газу теплота не будет равна совершенной им работе.
Рекомендуем скачать другие рефераты по теме: шпори для студентів, шпаргалки по математике транспорт реферат.
1 2 3 4 5 | Следующая страница реферата