Строение веществ. Систематика химических элементов
Категория реферата: Биология и химия
Теги реферата: куплю диплом о высшем образовании, реферат мировой
Добавил(а) на сайт: Царско.
Предыдущая страница реферата | 1 2 3 4 5 6 7 8 9 | Следующая страница реферата
Состояние электрона в атоме описывается с помощью квантовомеханической модели – электронного облака, плотность соответствующих участков которого пропорциональна вероятности нахождения электрона. Обычно под электронным облаком понимают область околоядерного пространства, которая охватывает примерно 90% электронного облака. Эта область пространства называется также орбиталью.
Существует система квантовых чисел, которая определяет состояние электрона в атоме.
Главное
квантовое число n определяет энергию электрона и размер электронного облака.
Оно может принимать целочисленные значения от 1 до ![]() .
.
Совокупность электронных состояний, имеющих одинаковое значение главного квантового числа n, называется электронным слоем или энергетическим уровнем.
Наименьшее значение энергии Е соответствует n =1. Остальным квантовым состояниям отвечают более высокие значения энергии. Электроны, находящиеся на этих энергетических уровнях, менее прочно связаны с ядром.
Для атома водорода квантовое состояние с n =1 соответствует его наименьшей энергии и называется основным. Состояния n = 2, 3, 4… называются возбужденными.
Орбитальное
(побочное) квантовое число ![]() определяет орбитальный момент количества
движения электрона и характеризует форму электронного облака. Оно принимает все
целочисленные значения от 0 до (n-1). Каждому n соответствует определенное
число значений
определяет орбитальный момент количества
движения электрона и характеризует форму электронного облака. Оно принимает все
целочисленные значения от 0 до (n-1). Каждому n соответствует определенное
число значений ![]() , то есть
энергетический уровень представляет собой совокупность энергетических
подуровней, несколько различающихся по энергиям. Число подуровней, на которое
расщепляется энергетический уровень, равно номеру уровня (то есть численному
значению n). Эти подуровни имеют следующие буквенные обозначения:
, то есть
энергетический уровень представляет собой совокупность энергетических
подуровней, несколько различающихся по энергиям. Число подуровней, на которое
расщепляется энергетический уровень, равно номеру уровня (то есть численному
значению n). Эти подуровни имеют следующие буквенные обозначения:
Орбитальное квантовое число: 0 1 2 3 4
Подуровень: s p d f g
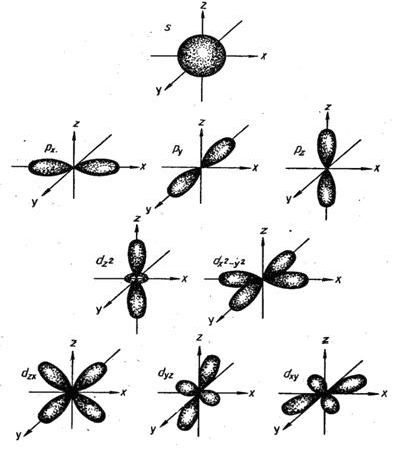
Формы
орбиталей, соответствующие различным значениям ![]() , приведены на
следующем рисунке:
, приведены на
следующем рисунке:
|
|
|
Рис. 1.1 Форма и пространственная ориентация электронных облаков s-, p- и d-орбиталей. |
Таким
образом, энергетический подуровень – это совокупность электронных состояний, характеризующихся определенным набором квантовых чисел n и ![]() . Такое
состояние электрона, соответствующее определенным значениям n и
. Такое
состояние электрона, соответствующее определенным значениям n и ![]() , записывается
в виде цифрового обозначения n и буквенного
, записывается
в виде цифрового обозначения n и буквенного ![]() , например, 4р
(n = 4,
, например, 4р
(n = 4, ![]() = 1); 5d (n = 5,
= 1); 5d (n = 5, ![]() = 2).
= 2).
Магнитное
квантовое число ml характеризует пространственную ориентацию электронного
облака. Оно принимает все целочисленные значения от ![]() до
до ![]() , например, при l=0 ml =0; l=1 ml = -1, 0, +1; l=2 ml = -2, -1, 0, +1, +2.
, например, при l=0 ml =0; l=1 ml = -1, 0, +1; l=2 ml = -2, -1, 0, +1, +2.
В общем виде любому значению l соответствует (2l+1) значений магнитного квантового числа, то есть (2l+1) возможных расположений электронного облака данного типа в пространстве. Следовательно, можно говорить, что число значений ml указывает на число орбиталей с данным значением l. s–состоянию соответствует одна орбиталь, p–состоянию – три, d–состоянию – пять, ¦-состоянию – семь и т.д. Все орбитали, принадлежащие одному подуровню, имеют одинаковую энергию и называются вырожденными.
Общее число орбиталей, из которых состоит любой энергетический уровень (слой), равно n2, а число орбиталей, составляющих подуровень, - (2l+1).
Спиновое квантовое число ms характеризует соответственно механический момент электрона, связанный с вращением его вокруг своей оси. Оно может иметь только два значения: +1/2 или -1/2.
Общая характеристика состояния электрона в многоэлектронном атоме определяется принципом Паули:
в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы.
Следовательно, на одной орбитали может находиться не более двух электронов, отличающихся друг от друга значениями спинового квантового числа (спинами); максимальная емкость энергетического подуровня - 2(2l+1) электронов, а уровня - 2n2.
Распределение электронов в атоме, находящихся в основном состоянии (его электронная конфигурация), определяется зарядом электрона. При этом электроны размещаются согласно принципа минимальной энергии:
наиболее устойчивое состояние электрона в атоме соответствует минимально возможному значению его энергии.
Конкретная реализация этого принципа может быть осуществлена на основе правила Клечковского:
с ростом атомного номера элемента электроны размещаются последовательно на орбиталях, характеризуемых возрастанием суммы главного и орбитального чисел (n+l);
Рекомендуем скачать другие рефераты по теме: доклад на тему, сочинение рассуждение на тему.
Предыдущая страница реферата | 1 2 3 4 5 6 7 8 9 | Следующая страница реферата