
Биосинтез белка и его регуляция
Категория реферата: Рефераты по биологии
Теги реферата: информационные рефераты, сочинение 5 класс
Добавил(а) на сайт: Циглер.
Предыдущая страница реферата | 1 2 3 4 5 6 | Следующая страница реферата
Регуляция синтеза белка
Основным условием существования любых живых организмов является наличие тонкой, гибкой, согласованно действующей системы регулирования, в которой все элементы тесно связаны друг с другом. В белковом синтезе не только количественный и качественный состав белков, но и время синтеза имеет прямое отношение ко многим проявлениям жизни. В частности, от этого зависит приспособление микроорганизмов к условиям окружающей питательной среды как биологической необходимости или приспособление сложного многоклеточного организма к физиологическим потребностям при изменении внутренних и внешних условий.
Клетки живых организмов обладают способностью синтезировать огромное количество разнообразных белков. Однако они никогда не синтезируют все белки. Количество и разнообразие белков, в частности ферментов, определяются степенью их участия в метаболизме. Более того, интенсивность обмена регулируется скоростью синтеза белка и параллельно контролируется аллостерическим путем. Таким образом, синтез белка регулируется внешними и внутренними условиями, которые диктуют клетке синтез такого количества белка и таких белков, которые необходимы для выполнения физиологических функций. Все это свидетельствует о весьма сложном, тонком и целесообразном механизме регуляции синтеза белка в клетке.
Общую теорию регуляции синтеза белка разработали Ф. Жакоб и Ж. Моно. Сущность этой теории сводится к «выключению» или «включению» генов как функционирующих единиц, к возможности или невозможности проявления их способности передавать закодированную в структурных генах ДНК генетическую информацию для синтеза специфических белков. Эта теория, доказанная в опытах на бактериях, получила широкое признание, хотя в эукариотических клетках механизм регуляции синтеза белка вероятно более сложный. У бактерий доказана индукция ферментов (т. е. синтез ферментов de novo) при добавлении в питательную среду субстратов этих ферментов. Добавление конечных продуктов реакции, образование которых катализируется этими же ферментами, напротив, вызывает уменьшение количества синтезируемых ферментов. Это последнее явление получило название репрессии синтеза ферментов. Оба явления — индукция и репрессия — взаимосвязаны.
Согласно теории Жакоба и Моно в биосинтезе белка у бактерий участвуют по крайней мере три типа генов: структурные гены, ген-регулятор и ген-оператор. Структурные гены определяют первичную структуру синтезируемого белка. Именно эти гены в цепи ДНК являются основой для биосинтеза мРНК, которая затем поступает в рибосому и, как было указано выше, служит матрицей для биосинтеза белка.
Синтез мРНК на структурных генах молекулы ДНК непосредственно контролируется определенным участком, называемым геном-оператором. Он служит как бы пусковым механизмом для функционирования структурных генов. Ген-оператор локализован на крайнем отрезке структурного гена или структурных генов, регулируемых им. «Считывание» генетического кода, т. е. формирование мРНК, начинается спромотора— участка ДНК, являющегося точкой инициации для синтеза мРНК, и далее распространяется последовательно вдоль оператора и структурных генов. Координированный одним оператором одиночный ген или группа структурных генов образует оперон.
В свою очередь деятельность оперона находится под контролирующим влиянием другого участка цепи ДНК, получившего название гена-регулятора. Поскольку структурные гены и ген-регулятор находятся в разных участках цепи ДНК, связь между ними, как предполагают Ф. Жакоб и Ж. Моно, осуществляется при помощи вещества-посредника, оказавшегося белком и названного репрессором. Образование репрессора происходит в рибосомах ядра на матрице специфической мРНК, синтезированной на гене-регуляторе. Репрессор имеет сродство к гену-оператору и обратимо соединяется с ним в комплекс. Образование такого комплекса приводит к блокированию синтеза мРНК и, следовательно, синтеза белка, т.е. функция гена-регулятора состоит, в том, чтобы через белок-репрессор прекращать деятельность структурных генов, синтезирующих мРНК. Репрессор, кроме того, обладает способностью строго специфически связываться с определенными низкомолекулярными веществами, называемыми индукторами, или эффекторами. Когда такой индуктор соединяется с репрессором, последний теряет способность связываться с геном-оператором, который таким образом выходит из-под контроля гена-регулятора, и начинается синтез мРНК.
Это типичный пример отрицательной формы контроля, когда индуктор, соединяясь с белком-репрессором, вызывает изменения его третичной структуры настолько, что репрессор теряет способность связываться с геном-оператором. Этот процесс аналогичен взаимоотношениям аллостерического центра фермента с эффектором, под влиянием которого изменяется третичная структура фермента и он теряет способность связываться со своим субстратом.
Механизм описанной регуляции синтеза белка и взаимоотношения репрессора со структурными генами были доказаны в опытах на Е. coli, на примере синтеза Р-галактозидазы (лактазы) — фермента, гидролизующего молочый сахар на глюкозу и галактозу. Дикий штамм Е. coli, обычно растущий на глюкозе, не может расти, если вместо глюкозы в питательную среду добавить лактозу (новый источник энергии и углерода) до тех пор, пока не будут синтезированы соответствующие ферменты (адаптивный синтез). При поступлении в клетку лактозы (индуктора) молекулы ее связываются с белком-репрессором и блокируют связь между репрессором и геном-оператором. При этом ген-оператор и структурные гены начинают снова функционировать и синтезировать необходимую мРНК, которая «дает команду» рибосомам синтезировать р-галактозидазу. Одновременно ген-регулятор продолжает вырабатывать репрессор, но он блокируется новыми молекулами лактозы, поэтому синтез фермента продолжается. Как только молекулы лактозы будут полностью расщеплены, репрессор освобождается и, поступив в ДНК, связывает ген-оператор и блокирует синтез мРНК, а следовательно, синтез Р-галактозидазы в рибосомах.
Таким образом, биосинтез мРНК, контролирующий синтез белка в рибосомах, зависит от функционального состояния репрессора. Если репрессор, который представляет собой белок, построенный из 4 субъединиц с общей молекулярной массой около 150000 Да, находится в активном состоянии, не связан с индуктором, то он блокирует ген-оператор и синтез мРНК не происходит. При поступлении метаболита-индуктора в клетку его молекулы связывают репрессор, превращая его в неактивную форму (или, возможно, снижая его сродство к гену-оператору). Структурные гены выходят из-под запрещающего контроля и начинают синтезировать нужную мРНК.
Выше было указано, что концентрация ряда ферментов в клетках резко снижается при увеличении концентрации отдаленных конечных продуктов, образующихся в цепи последовательных ферментативных реакций. Такой эффект, получивший название репрессии ферментов, часто наблюдается при реакциях биосинтеза. В этих случаях оказалось, что молекулы репрессора, также образующиеся в рибосомах ядра по «команде» гена-регулятора, являются неактивными и сами по себе не обладают способностью подавлять деятельность гена-оператора и, следовательно, всего оперона, но приобретают такую способность после образования комплекса с конечным или одним из конечных продуктов биосинтетического процесса.
Конечный продукт выступает, таким образом, в качестве корепрессора. Имеются данные, показывающие, что в качестве корепрессоров в синтезе ферментов обмена аминокислот выступает не свободная аминокислота как конечный продукт биосинтетической реакции, а комплекс ее с тРНК — аа-тРНК.
В регуляции экспрессии структурных генов специфическое участие принимает особый белок, получивший название катаболитный ген-активирующий белок (от англ, catabolite gene activation protein, сокращенно обозначаемый САР); этот белок взаимодействует с цАМФ, образуя комплекс, способствующий прикреплению РНК-полимеразы к промоторному участку генома. В присутствии комплекса САР-цАМФ фермент может начать транскрипцию оперона, включая структурные гены, т. е. в клетках имеется еще один, дополнительный САР-цАМФ регулятор, действующий скорее всего в качестве положительного регулятора, поскольку его присутствие необходимо для начала экспрессии гена. Таким образом, концепции Жакоба и Моно о механизме проявления активности генов признана одним из блестящих достижений молекулярной биологии. Она явилась логическим развитием многочисленных исследований, проведенных генетиками и биохимиками в предшествующие десятилетия.
В заключение следует вкратце рассмотреть вопрос о регуляции процессов дифференцировки клеток высших организмов. ДНК, присутствующая во всех соматических клетках, вероятнее всего, имеет одинаковую первичную структуру у данного организма и соответственно располагает информацией для синтеза любых или всех белков тела. Тем не менее клетки печени, например, синтезируют сывороточные белки, а клетки молочной железы — белки молока. Нет сомнения в том, что в дифференцированных клетках, очевидно, существует тонкий механизм контроля деятельности ДНК в разных тканях, обеспечивающий синтез многообразия белков.
Механизмы, лежащие в основе этой регуляции, пока неизвестны. Для объяснения их имеется ряд гипотез. Предполагается, что контроль осуществляется на уровне транскрипции по аналогии с индукцией ферментов у бактерий и что в этом случае в клетках животных должны функционировать аналогичные репрессоры.. Поскольку с молекулой ДНК у зукариот связаны гистоны, считается, что именно они выполняют роль репрессоров. Однако прямые доказательства их роли в качестве репрессоров отсутствуют, как и точные данные о существовании и природе каких-либо репрессоров в клетках эукариот. Высказано предположение, что в ядре синтезируется гигантская молекула мРНК, содержащая информацию для синтеза широкого разнообразия белков, но в цитоплазму, как было показано выше, попадает только небольшая часть зрелой мРНК, а основная часть распадается. Неясны, однако, биологический смысл и назначение этого механизма избирательного распада и, соответственно, траты огромной части молекулы мРНК.
Существует еще одно предположение, что на ДНК клетки синтезируются все возможные мРНК, которые поступают в цитоплазму, и процесс трансляции регулируется путем специфического и избирательного взаимодействия с определенными молекулами мРНК.
Ингибиторы синтеза белка
Одним из путей выяснения механизмов синтеза нуклеиновых кислот и белков в клетках является использование таких лекарственных препаратов, которые могли бы избирательно тормозить эти процессы у бактерий, не оказывая влияния на организм человека. Некоторые препараты действительно обладают таким действием, однако многие из них оказываются токсичными и для человека. В настоящее время в медицинской практике применяются многие антибиотики, часть из которых будет рассмотрена ниже с целью выяснения механизма их действия на ключевые химические реакции синтеза белка и нуклеиновых кислот.
Одним из мощных ингибиторов белкового синтеза является пуромицин. В результате структурного сходства с концевым остатком АМФ в аминоацил-тРНК' он легко взаимодействует с А-участком пептидил-тРНК с образованием пептидил-пуро-мицина.
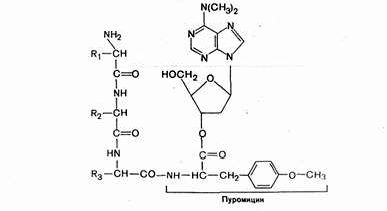
Поскольку пептидил-пуромицин не несет на себе триплета антикодона, он тем самым тормозит элонгацию пептидной цепи, вызывая обрыв реакции. При помощи пуромицина было доказано, например, что гормональный эффект в ряде случаев зависит от синтеза белка de novo. Укажем также, что пуромицин тормозит синтез белка как у прокариот, так и у эукариот.
Белковый синтез тормозится актиномицином D, обладающим противоопухолевым эффектом, который вследствие высокой токсичности применяется редко. Он оказывает тормозящее влияние на синтез всех типов клеточной РНК, в особенности мРНК. Это свойство вызвано тормозящим влиянием актиномицина D на ДНК-зависимую РНК-полимеразу, поскольку он связывается с остатками дезоксигуанозина цепи ДНК, выключая матричную функцию последней. Можно считать, что актиномицин D ингибирует транскрипцию ДНК.
Другим антибиотиком, также тормозящим синтез клеточной РНК, является используемый при лечении туберкулеза рифамицин. Этот препарат тормозит ДНК-зависимую РНК-полимеразу путем связывания с ферментом. Наиболее чувствительна к нему бактериальная РНК-полимераза. На организм животных этот антибиотик оказывает незначительное влияние. По механизму действия он резко отличается от актиномицина t). Следует указать на недавно открытое противовирусное действие рифамицина, в частности, он успешно используется при лечении трахомы, которая вызывается ДНК-содержащим вирусом. По-видимому, этот антибиотик найдет применение в лечении опухолей, вызываемых вирусами.
Выяснены механизмы действия ряда других антибиотиков, применяемых при лечении тифозных инфекций. Так, хлорамфеникол оказывает ингибирующее влияние на пептидилтрансферазную реакцию (на стадии элонгации) синтеза белка в 70S рибосоме бактерий. На этот процесс в 80S рибосоме он не действует. Противоположное тормозящее действие на синтез белка в 80S (без поражения процесса в 70S рибосоме) оказывает циклогексимид, являющийся ингибитором транслоказы.
Весьма интересен молекулярный механизм действия дифтерийного токсина. Он оказался наделен способностью катализировать реакцию АДФ-рибозилирования фактора элонгации (трансляционный фактор-2, TF-2). выключая тем самым его из участия в синтезе белка. Резистентность многих животных к дифтерийному токсину обусловлена трудностью проникновения токсина через мембрану клеток.
Противотуберкулезные и антибактериальные антибиотики, в частности стрептомицин и неомицин, действуют на белоксинтезирующий аппарат чувствительных к ним -штаммов бактерий. Высказано предположение, что эти антибиотики вызывают ошибки в трансляции мРНК, приводящие к нарушению соответствия между кодонами и включаемыми аминокислотами; например, кодон УУУ вместо фенилаланина начинает кодировать лейцин — в результате образуется аномальный белок, что приводит к гибели бактерий.
Широко применяемые в клинике тетрациклины также оказались ингибиторами синтеза белка в 70S рибосоме (меньше тормозится синтез в 80S рибосоме). Они легко проникают через клеточную мембрану. Считается, что тетрациклины тормозят связывание аминоацил-тРНК с аминоацильным центром в 50S субчастице рибосомы. Возможно, что тетрациклины химически связываются с этим центром, выключая тем самым одну из ведущих стадий процесса трансляции.
Рекомендуем скачать другие рефераты по теме: реферат предприятие, реферат на тему общество.
Предыдущая страница реферата | 1 2 3 4 5 6 | Следующая страница реферата