
Одноклеточные альтруисты
Категория реферата: Рефераты по биологии
Теги реферата: ответы по контрольной, информационные технологии реферат
Добавил(а) на сайт: Емельяненко.
Предыдущая страница реферата | 1 2 3 | Следующая страница реферата
В матриксе протоны соединяются с кислородом, восстановленным в ходе работы электронтранспортной цепи, и образуется вода. Но если он восстанавливается не полностью, появляются активные формы кислорода (АФК): супероксидный радикал (О2·–), перекись водорода (Н2О2) и гидроксильный радикал (ОН·). В митохондриях образование АФК, этого побочного продукта, усиливается при повышении скорости потока электронов, увеличении концентрации кислорода и разобщении дыхания и окислительного фосфорилирования веществами, которые вызывают проницаемость внутренней мембраны.
Органеллы, обеспечивающие жизнедеятельность клетки, обеспечивают и ее смерть. При сильном стрессовом воздействии (переохлаждении; нагревании; стимуляции образования АФК другими структурами клетки, помимо митохондрий; перекисном окислении липидов плазматической мембраны - чаще всего при облучении) в цитоплазме резко повышается концентрация ионов кальция. Если кальциевые депо клетки не справляются с его утилизацией, открывается так называемая митохондриальная пора диаметром 2.6-2.9 нм. Она представляет собой канал, проходящий через обе митохондриальные мембраны и состоящий из трех белков: транслокатора адениновых нуклеотидов, потенциалзависимого анионного канала (порина) и бензодиазепинового рецептора. Когда этот комплекс связывается с Са2+, через мембранную пору могут проходить вещества с небольшой молекулярной массой. Это приводит к падению мембранного потенциала и набуханию матрикса, целостность внешней мембраны неизбежно нарушается, и из межмембранного пространства в цитоплазму выходят белки апоптоза. Их несколько: фактор, индуцирующий апоптоз (APOptosis-inducing factor - AIF), вторичный митохондриальный активатор каспаз (second mitochondria-derived activator of caspases - Smac) и некоторые прокаспазы. Индуцирующий фактор направляется прямо в ядро, где вызывает деградацию ДНК.
Наряду со специфически апоптозными белками, из митохондрии через открытую пору выходит цитохром с, который в норме служит конечным звеном электронтранспортной цепи. В цитоплазме этот белок связывается с белком Apaf-1 (APOptotic protease activating factor-1 - активирующий протеазу фактор-1) и формирует апоптосомный комплекс. Он с помощью Smac и еще одного фактора (Omi/HtrA2) активирует прокаспазу-9, та, став каспазой-9, превращает два других профермента в каспазы-3 и -7; а они уже расщепляют структурные белки, приводя к появлению биохимических и морфологических признаков апоптоза. В числе первых можно назвать, в частности, переход фосфатидилсерина в наружный мембранный слой и фрагментацию ДНК. Из вторых признаков наиболее характерны “отшелушивание” клетки от матрикса, сморщивание мембраны, сжатие ядра и формирование пузырьков с клеточным содержимым - апоптозных телец.
Цитохром с электростатически и гидрофобно связан с внутренней мембраной митохондрий через фосфолипиды, преимущественно через кардиолипин. Электростатически взаимодействуют между собой положительно заряженные остатки аминокислоты лизина в цитохроме и отрицательно заряженные фосфатные группы в кардиолипине. За счет гидрофобного взаимодействия между углеродной цепью этого фосфолипида и гидрофобными участками молекулы цитохрома еще более укрепляется связь фермента с митохондриальной мембраной, что обеспечивает даже его частичное погружение в ее слой.
Следовательно, для выхода цитохрома с в цитоплазму одного лишь нарушения целостности митохондриальной мембраны недостаточно. Электростатически связанный цитохром с может оторваться от кардиолипина, если изменяется ионная сила, плотность поверхностного заряда или рН, а связанный гидрофобно - за счет окислительной модификации митохондриальных липидов. Последнюю реакцию как раз и вызывают активные формы кислорода, которые неизбежно образуются при любых сильных воздействиях (стрессах), а открывание поры усиливает этот процесс.
Однако цитохром с не всегда нужен для запрограммированной смерти. Апоптоз в сердечной ткани, например, вообще протекает без этого фермента, он так и не выходит из межмембранного пространства.
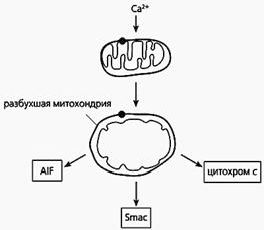
Фрагмент схемы апоптоза, протекающего по митохондриальному пути.
Под действием избытка ионов кальция митохондрия разбухает, через пору из нее выходит цитохром с и два белка - AIF и Smac. Первый белок индуцирует апоптоз, а второй активирует некоторые прокаспазы.
Цитохром с может высвобождаться в ответ на повышение концентрации ионов Са2+, которое вызывает открывание поры. Но выход фермента “на свободу” может и не зависеть от этих ионов, тогда процесс контролируют белки семейства Bcl-2 (B-cell leukaemia-2 - лейкемия В-клеток-2). Именно они регулируют апоптоз на уровне митохондрий. Одни из белков этого большого семейства (Bcl-2, а также Bcl-xL, Bcl-w, Mcl-1, Al и Boo) предотвращают апоптоз; другие (Вах, Bad, Bok, Bcl-xS, Bak, Bid, Bik, Bim, Krk, и Mtd) способствуют самоубийству. Вот один пример работы белков этого семейства регуляторов. Цитозольный белок Bid расщепляется каспазой-8, активируемой через “рецепторы смерти”, и лизосомными протеазами катепсинами, чей выход из лизосом стимулирует эта же каспаза. Образовавшийся активный белок - усеченный Bid (truncated Bid - t-Bid) - изменяет конформацию другого проапоптозного белка, Вах, после чего тот встраивается во внешнюю мембрану митохондрий, где формирует комплекс с порином. Вместе они выстилают канал, по которому из межмембранного пространства выходят цитохром с и проапоптозные белки. Но если в дело вмешивается Bcl-2, действующий как антиоксидант, выход цитохрома блокируется.
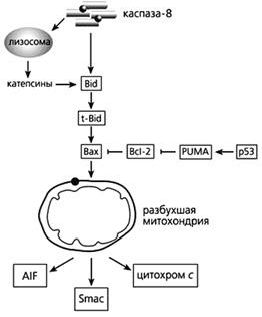
Фрагмент схемы апоптоза, протекающего под контролем белков семейства Bcl-2, а также с участием p53.
Объяснения в тексте.
В запуске апоптоза, вызванного повреждениями ДНК, активацией онкогенов и гипоксией, принимает участие белок-53 (р53), взаимодействуя с Вах, стимулируя “рецепторы смерти” и апоптозные гены. р53 активирует модулятор суицида PUMA (p53 upregulated modulator of APOptosis), который затем связывает Bcl-2 и выводит из строя этот препятствующий апоптозу белок. Тем самым выход цитохрома с из митохондрий уже ничем не сдерживается.
Некоторые белки, связывающие ионы кальция, например ALG-2, кодируемый одноименным геном (APOptosis-linked gene-2), тоже принимают участие в запрограммированной смерти. Так, взаимодействием ALG-2 и белка Alix (ALG-interacting protein X, известный и как AIP1) осуществляется регуляция апоптоза. Часть сложной молекулы ALG-2 представляет собой еще один апоптозный белок кальпоин.
Кальпоины специфически расщепляют белки, содержащие области, называемые PAST-мотивами и богатые остатками четырех аминокислот - пролина (P), аспарагиновой кислоты (A), серина (S) и треонина (T). (Среди этих белков - фермент ДНК-лигаза, у которого такой мотив находится в N-концевой области.) Кроме того, кальпоины освобождают каспазы от связанных с ними ингибиторов апоптозных белков (inhibitors of APOptosis proteins, IAPs).
Впервые обнаруженные у вирусов, гомологи IAP позже были найдены у всех эукариот, от дрожжей до млекопитающих. У последних открыто восемь представителей этого семейства ингибиторов, и каждый имеет от одного до трех 70-аминокислотных участков, называемых BIR-доменами (baculoviruses inhibitor of APOptosis repeat domains - повторяющиеся домены бакуловирусного ингибитора апоптоза). Кодируемый Х-хромосомой IAP (XIAP) и клеточные ингибиторы апоптозных белков (cellular inhibitors of APOptosis protein; cIAP1, 2) содержат по три N-концевых BIR-домена и С-концевой RING-домен, кодируемый геном ring (really interesting new gene - действительно интересный новый ген). Эти белки ингибируют каспазы-3, -7, -9: BIR-домены целенаправленно связываются с ними, блокируя их активные центры; RING-домен обеспечивает деградацию каспаз, пришивая к ним “черную метку” - 76-аминокислотный белок убиквитин. Присоединившие его белки подвергаются расщеплению протеасомой *.
* Об этом специфическом пути деградации белков см.: Абрамова Е.Б., Карпов В.Л. Протеасома: разрушение во имя созидания // Природа. 2003. №7. С.36-45.
Есть и другой эндогенный ингибитор каспаз - FLIP (FLICE-inhibitory protein). Он взаимодействует с пособниками суицида - сигнальными комплексами, блокируя активацию прокаспазы-8 и передачу проапоптического сигнала от “рецепторов смерти”.
Как все ингибиторы протеаз, XIAP, cIAP1 и cIAP2 сами подвержены отрицательной регуляции. В частности, митохондриальный полипептид Smac/DIABLO (direct IAP-binding protein with low pI - белок с низкой pI, прямо связывающий IAP), выходя из митохондрий в цитозоль, связывается с ингибиторами XIAP, cIAP1 и cIAP2 и мешает им взаимодействовать с каспазами. Но XIAP, cIAP1 и 2 способны противостоять ингибирующему действию Smac/DIABLO, присоединяя к нему убиквитин - сигнал для деградации. Одна из изоформ Smac/DIABLO, Smac3, сама стимулирует присоединение убиквитина к XIAP. В высоких концентрациях каспазы-3 и -7 могут расщеплять XIAP и без посредников.
Как видим, клетка никогда не бросается в апоптоз без “раздумий”. Она сначала задает себе гамлетовский вопрос: “Быть или не быть?”. Ответ на него зависит от соотношения про- и антиапоптозных белков; между ними идет борьба, и побеждает та сторона, которая успевает навесить на другую “черную метку” - убиквитин. А протеазам совершенно все равно, на ком эта метка - они беспристрастно расщепляют меченые белки. Таким образом, выбор клетки между жизнью и смертью зависит не столько от внешних обстоятельств, сколько от ее собственного внутреннего состояния. Даже если организм приказывает клетке погибнуть, она подчиняется ему только в том случае, когда сама расположена к такому исходу. Бывают мутанты, которые категорически не хотят умирать, при том что все внешние обстоятельства побуждают их к суициду - как правило, это раковые клетки.
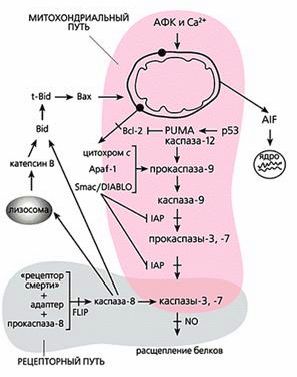
Общая схема “классического” апоптоза млекопитающих.
Мы перечислили все виды орудий самоубийства, которыми клетка многоклеточного организма пользуется, когда он приказывает и когда она сама того хочет. Но следует понимать, что их действие неоднозначно. Например, кальций и активные формы кислорода участвуют во всех без исключения процессах жизнедеятельности как вторичные посредники в передаче сигналов и регулируют все функции клетки: размножение, дыхание, обмен веществ, движение, рост. Тот же кальций способен, в частности, активировать антиоксидантные ферменты, защищающие клетку от окислительного стресса. АФК в микромолярных концентрациях необходимы для пролиферации клеток, их подвижности и хеморецепции; более того, некоторые виды (например, NO) даже блокируют апоптоз посредством избирательного нитрозилирования эффекторных каспаз. Да и каспазы тоже могут выполнять вполне “мирные” функции - управлять дифференцировкой некоторых типов клеток.
Таким образом, лишь немногие из орудий самоубийства служат только этой цели: большинством из них клетка пользуется и в “домашнем быту”. Возникает вопрос: а все ли они необходимы для совершения суицида? И если нет, то зачем производить столь непомерный арсенал орудий? На эти вопросы мы сможем ответить, когда рассмотрим специфику протекания запрограммированной смерти у одноклеточных организмов.
Суицид у одноклеточных
Практически у всех простейших организмов внешние признаки апоптоза те же самые, что у клеток многоклеточных, и, как у них, к гибели приводят разные причины. У одноклеточных водорослей ее вызывает отсутствие света или окислительный стресс, а предотвращают ингибиторы каспаз и антиоксидантный фермент, расщепляющий Н2О2, - каталаза (каспазы у них тоже выявлены - с помощью антител). Паразитические жгутиконосцы кончают жизнь самоубийством, если им помогают ингибитор протеинкиназы С ставроспорин (он же стимулирует апоптоз и в клетках млекопитающих) и перекись водорода, а предотвращают тоже ингибиторы каспаз. Экстракт цитоплазмы паразитического простейшего Leishmania major в опытах вызывал характерные для апоптоза изменения в изолированных ядрах млекопитающих, свидетельствуя о присутствии в нем AIF-подобных белков. Изолированные митохондрии L.major теряли цитохром c при инкубации с рекомбинантным Вах человека даже тогда, когда Вах был лишен трансмембранного домена, необходимого для встраивания в наружные мембраны митохондрий. Следовательно, у L.major есть белки, способные взаимодействовать с Вах.
Рекомендуем скачать другие рефераты по теме: реферати, отцы и дети сочинение.
Предыдущая страница реферата | 1 2 3 | Следующая страница реферата