
Двигатели внутреннего сгорания на сжиженном водороде
Категория реферата: Рефераты по истории техники
Теги реферата: решебник по английскому языку, реферат экономическое развитие
Добавил(а) на сайт: Mina.
Предыдущая страница реферата | 1 2
Уже в 2003 году начнется продажа ограниченной партии FCHV-4 (Full Cell Hybrid Vehicle). Сколько будет стоить этот уникальный автомобиль, пока не сообщается. Известно только, что мощность мотора составляет 107 л.с., а максимальная скорость FCHV-4 равна 150 км/час.
ТОПЛИВО НА БУДУЩЕЕУдельная масса водорода невелика, а вот его перспективы в автомобилестроении расцениваются как весьма солидные.
Топливный кризис 70-х годов заставил многие автомобильные компании по-новому взглянуть на альтернативные виды горючего.
Тогда-то и был отмечен первый всплеск интереса к водороду. А что, этот "кандидат" выглядел вполне многообещающе. Водорода на Земле – море. В
прямом смысле слова, ведь его можно получать из воды…
Однако вскоре кризис пошел на убыль, нефтепроводы заработали на полную
мощность, а водородные проблемы были, на первый взгляд, отодвинуты в дальние углы академических лабораторий. Однако прошло двадцать лет, и теперь эти
исследования, похоже, обрели второе дыхание – они оказались созвучны современным "экологическим" настроениям. Действительно: сжигаем
водород – получаем воду. Как ни взгляни – вполне нейтральный и безвредный продукт.
ГДЕ ЕГО ВЗЯТЬ?

![]() Расположение агрегатов "Тойоты FCEV":
Расположение агрегатов "Тойоты FCEV":
1 – двигатель; 2 – электронный блок управления;
3 – топливные элементы; 4 – реактор преобразо-
вания метанола в водород; 5 – топливный бак;
6 – аккумуляторы.
Как всегда, в новом и перспективном деле множество вариантов. Единообразие придет потом, а пока выбор довольно велик. Самое
простое – вместо бензобака разместить на автомобиле баллоны со сжатым водородом. Подходящая аппаратура уже существует – ведь в мире немало автомобилей
работает на сжатом газе. Правда, природном, но приспособить эти устройства относительно легко. Конечно, и сам двигатель придется переделывать, но об этом
чуть позже. Такой путь, хотя и кажется простым, все-таки маловероятен. Трудно представить водителя, который добровольно согласится возить емкости со сжатым
до 200 кгс/см2 водородом, к тому же способным коварно проникать через мельчайшие неплотности топливной аппаратуры. В чем намного превосходит
природный газ, состоящий из более "тяжелых и неповоротливых" молекул и потому менее склонный к утечкам. А еще каждый, безусловно, припомнит
"гремучий газ" – взрывоопасную смесь водорода с кислородом в объемном соотношении 2:1.
Не более перспективным выглядит и сжиженный водород. Кому захочется иметь дело с топливом, которое нужно хранить при –253°С? И на какие технические ухищрения
придется идти конструкторам, чтобы поддерживать такой холод сколько-нибудь длительное время? Итак, этот вариант пока тоже отпадает.
К счастью, есть еще одна возможность – гидриды. Напомним, что атомы металлов располагаются в определенном порядке, их "построение" 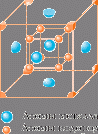 называют кристаллической решеткой. Так вот, некоторые
металлы и сплавы способны "разместить" между своими атомами и атомы водорода. Такие "сообщества" и называют гидридами.
называют кристаллической решеткой. Так вот, некоторые
металлы и сплавы способны "разместить" между своими атомами и атомы водорода. Такие "сообщества" и называют гидридами.
Так размещаются атомы водорода в
кристаллической решетке металла.
Не вдаваясь в подробности, заметим, что емкость подобного "хранилища" (при равном объеме устройства) впятеро выше, чем у баллона со сжатым газом, и почти вдвое – чем у дьюара со сжиженным. Исследователи настойчиво ищут наиболее походящие сплавы, но уже известно, что
наилучшей основой для них является титан. Гидридные накопители штука довольно сложная, и, естественно, они не состоят из цельного куска металла, а больше
напоминают губку со множеством каналов – для скорейшего поглощения и выделения водорода. Последнее происходит при нагреве гидридов, а уж источник тепла на
автомобиле долго искать не нужно – скажем, для этой цели вполне подойдут горячие выхлопные газы. Еще одна важная черта гидридов – они стократ безопаснее
других способов хранения водорода. Правда, для автомобильного транспорта емкость и у них маловата, а вес и сложность устройства, напротив, велики.
Резонно задать вопрос: если хранение вызывает такие трудности, нельзя ли получать водород непосредственно на автомобиле? Оказывается, можно. Самым
перспективным считается способ, при котором сырьем служит метанол, или, по старой российской классификации, метиловый спирт – "младший братец"
известного всем этилового. Родственничек-то, правда, с характером – ядовит, но это если его пить, а вообще-то он применяется довольно широко – даже входит в
состав большинства автомобильных жидкостей для мытья стекол.
Итак, бак автомобиля – по сути, вполне обычный – наполняют легкой жидкостью с
резким спиртовым запахом. Отсюда она попадает в реактор (не пугайтесь, не ядерный, а химический), испаряется и в присутствии катализатора реагирует с
водяным паром, выделяя водород и двуокись углерода.
Топливо получено, осталось его использовать. Кстати, можно провести реакцию
другим способом, тогда вторым из продуктов окажется не СО2, а СО (тот самый, с которым борются экологи); смесь последнего с водородом получила название
синтез-газ. Поскольку Н2 и СО горючи, их можно вместе непосредственно сжигать в цилиндрах двигателя внутреннего сгорания. Подобные эксперименты проводились во
множестве лабораторий, в том числе и у нас в НАМИ.
ЖЕЧЬ ИЛИ НЕ ЖЕЧЬ?
Более чем столетняя традиция транспортных средств с моторами внутреннего сгорания практически однозначно решает этот вопрос в пользу первого варианта. Такой путь сулит определенные выгоды – повышается эффективный КПД двигателя, единственным прямым продуктом реакции является водяной пар, и даже оксидов азота (они образуются при высокой температуре из кислорода и азота воздуха) выбрасывается в атмосферу в 4–5 раз меньше (данные НАМИ), чем при езде на бензине.

|

|
| Структура топливного эелемента. | Схема топливного элемента. |
Определенную опасность представляют вспышки "гремучего газа" в коллекторе в момент открытия впускного клапана.
Чтобы избежать этого, инженеры в 70-е годы предполагали подавать водород непосредственно в камеру сгорания. На чертежах тех лет нетрудно заметить
дополнительный канал в головке блока цилиндров и маленький клапан, управляющий поступлением водорода. Позднее выяснилось, что проблему можно решить по-другому
– скажем, впрыскивать в рабочую смесь воду или обеспечить рециркуляцию отработавших газов (тоже, по сути, водяного пара). К преимуществам водорода как
моторного топлива следует отнести его высокую детонационную стойкость, что позволяет заметно увеличить степень сжатия и давление наддува. Эти меры
поднимут эффективную мощность двигателя (при "бензиновых" степенях сжатия из-за меньшего коэффициента наполнения мощность двигателя на водороде
оказывается Схема реактора. меньше). Проводились эксперименты и по использованию
водорода в... 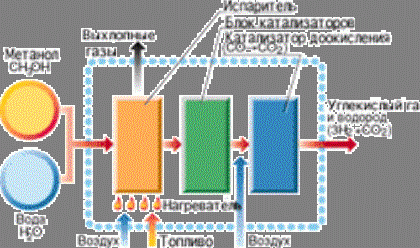 дизеле. Правда, в газодизельном цикле небольшая порция
жидкого топлива подавалась в цилиндр, чтобы инициировать начало горения. Дизелю водород тоже пошел бы на пользу – с ним выбросы сажи и твердых частиц сводятся
почти к нулю.
дизеле. Правда, в газодизельном цикле небольшая порция
жидкого топлива подавалась в цилиндр, чтобы инициировать начало горения. Дизелю водород тоже пошел бы на пользу – с ним выбросы сажи и твердых частиц сводятся
почти к нулю.
На первый взгляд, добавить к тому, что сказано, вроде бы нечего, если не
погружаться в рассуждения о том, что лучше сжигать: чистый водород, синтез-газ или их всевозможные смеси с бензином, метанолом, соляркой... Но, оказывается, не все специалисты мыслят столь прямолинейно. Некоторые, раз ступив на путь исследований в области химии водорода, уже и слышать не хотят о двигателях
внутреннего сгорания. И вот, благодаря усилиям конструкторов на сцене появляется новое удивительное устройство, позволяющее при реакции водорода с
кислородом получить электрическую энергию непосредственно!
Многие, вероятно, помнят школьные опыты по электролизу: в воду опускают два электрода, подводят определенное напряжение, и
на одном из них начинает выделяться водород, а на другом – кислород. Здесь же все происходит с точностью до наоборот. Водород в чем-то сродни металлам, и его
атом легко теряет свой единственный электрон. В устройстве, получившем название водородный топливный элемент, реакция водорода с кислородом происходит в
несколько стадий. Сперва водород вынужден пройти через ионообменную мембрану, которая свободно пропускает лишь протоны – лишенные электрона атомы водорода
(Н+), а вовсе не его молекулы Н2. Электроны при этом остаются на отрицательном электроде (он же – платиновый катализатор). Пройдя через мембрану, водород
вновь получает свой электрон – в момент реакции с кислородом воздуха, на положительном (и тоже платиновом) электроде. Электроны же вынуждены идти
"кружным путем", через электрическую цепь, производя при этом полезную работу.
Ну вот, осталось подключить электродвигатель, блок управления и... батарею аккумуляторов. Последняя, естественно, меньше, чем в электромобилях, и служит
для приведения всего устройства в рабочее состояние, а также сглаживает пиковые нагрузки на топливный элемент и сохраняет энергию при торможении.
Опытные экземпляры транспортных средств с такой чудовищной по сложности силовой установкой уже бегают по полигонам многих зарубежных автомобильных концернов, а
"Тойота" даже представила свою модель FCEV (электромобиль с топливными элементами) на Токийском автосалоне в конце прошлого года. Занимаются
этой тематикой и "Мерседес", и американцы, но наиболее активны японцы. По правде говоря, пока сложность и стоимость таких автомобилей
многократно превосходят их эффективность, но, как знать, в будущем ситуация может измениться.
Говорят, что в Японии регулярно проводят конкурсы на транспортное средство с наиболее сложными преобразованиями энергии. Несколько лет назад в таком
соревновании победил некий энтузиаст, придумавший... велосипед. Вращение педалей этого замысловатого устройства приводило к трению двух брусочков, которые, нагреваясь, кипятили воду. Небольшая паровая машина вращала генератор, а колеса приводились в действие электромотором. Что самое удивительное, этот
велосипед был способен двигаться (правда, чрезвычайно неспешно)! Жюри такая конструкция показалась просто уникальной. Но ведь тогда еще не построили
"Тойоту FCEV"!..
Скачали данный реферат: Jacevich, Tolstokozhev, Kustov, Ястремский, Маркеллина, Шелепин, Zykov.
Последние просмотренные рефераты на тему: реферат на экономическую тему, красные дипломы, куплю диплом о высшем образовании, готовые дипломные работы.
Предыдущая страница реферата | 1 2