|
(NH4)2SO4
|
MgSO4
|
NaHCO3
|
NaNO3
|
KNO3
|
|
r, –Љ–Ї–Љ
|
25,0
|
4,3
|
10,5
|
10,5
|
16,5
|
21,0
|
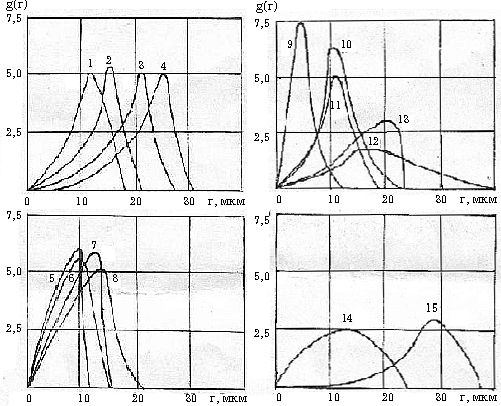
–†–Є—Б
1. –Ъ—А–Є–≤—Л–µ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П g(r) –≥–ї–Њ–±—Г–ї –≤–Њ–і—Л –≤ 5% –≤/–љ —Н–Љ—Г–ї—М—Б–Є—П—Е, –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–љ—Л—Е –љ–∞
–Њ—Б–љ–Њ–≤–µ IN-—А–∞—Б—В–≤–Њ—А–Њ–≤ —Н–ї–µ–Ї—В—А–Њ–ї–Є—В–Њ–≤: 1 - NaCl, 2 - KCl, 3 - KBr, 4 - Kl, 5 - MgCl2, 6 - CaCl2, 7 - SrCL2, 8 - BaCl2 , 9 - (NH4)2SO4, 10 - MgSO4, 11 - NaHCO3, 12 -
NaNO3, 13 - KNO3, –∞ —В–∞–Ї–ґ–µ –њ—А–µ—Б–љ–Њ–є (14) –Є –њ–ї–∞—Б—В–Њ–≤–Њ–є (15) –≤–Њ–і—Л.
–Ъ–Њ
–≤—В–Њ—А–Њ–є –≥—А—Г–њ–њ–µ –Њ—В–љ–Њ—Б—П—В—Б—П —Н–Љ—Г–ї—М—Б–Є–Є, –Њ–±—А–∞–Ј–Њ–≤–∞–љ–љ—Л–µ –≤–Њ–і–љ—Л–Љ–Є —А–∞—Б—В–≤–Њ—А–∞–Љ–Є –≥–∞–ї–Њ–≥–µ–љ–Є–і–Њ–≤
–Ї–∞–ї–Є—П, –∞ —В–∞–Ї–ґ–µ –∞–Ј–Њ—В–љ–Њ–Ї–Є—Б–ї—Л–Љ –љ–∞—В—А–Є–µ–Љ –Є –Ї–∞–ї–Є–µ–Љ. –°—А–µ–і–љ–Є–µ —А–∞–Ј–Љ–µ—А—Л –≥–ї–Њ–±—Г–ї –≤–Њ–і—Л –≤ –љ–Є—Е
–±–Њ–ї—М—И–µ, —З–µ–Љ –≤ —Н–Љ—Г–ї—М—Б–Є–Є, –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–љ–Њ–є –љ–∞ –Њ—Б–љ–Њ–≤–µ –њ—А–µ—Б–љ–Њ–є –≤–Њ–і—Л. –Ъ —Н—В–Њ–є –ґ–µ –≥—А—Г–њ–њ–µ
–Њ—В–љ–Њ—Б–Є—В—Б—П —Н–Љ—Г–ї—М—Б–Є—П –љ–∞ –Њ—Б–љ–Њ–≤–µ –њ–ї–∞—Б—В–Њ–≤–Њ–є –≤–Њ–і—Л, –њ—А–Є—З–µ–Љ —Б—А–µ–і–љ–Є–µ —А–∞–Ј–Љ–µ—А—Л –≥–ї–Њ–±—Г–ї –≤–Њ–і—Л
(r–њ–ї–∞—Б—В=30,0 –Љ–Ї–Љ) –≤ —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ—Л.
–Я–Њ–ї—Г—З–µ–љ–љ—Л–µ
—А–µ–Ј—Г–ї—М—В–∞—В—Л –љ–∞—Е–Њ–і—П—В—Б—П –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П–Љ–Є –Њ —Б—В—А—Г–Ї—В—Г—А–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є—П—Е, –њ—А–Њ–Є—Б—Е–Њ–і—П—Й–Є—Е –≤ –≤–Њ–і–µ –њ—А–Є —А–∞—Б—В–≤–Њ—А–µ–љ–Є–Є –≤ –љ–µ–є —Н–ї–µ–Ї—В—А–Њ–ї–Є—В–Њ–≤. –≠–ї–µ–Ї—В—А–Њ–ї–Є—В—Л, –Њ–±—А–∞–Ј—Г—О—Й–Є–µ
—Н–Љ—Г–ї—М—Б–Є–Є –њ–µ—А–≤–Њ–є –≥—А—Г–њ–њ—Л, –њ–Њ –Ј–љ–∞–Ї—Г –Є–љ—В–µ–≥—А–∞–ї—М–љ—Л—Е —В–µ–њ–ї–Њ—В —А–∞—Б—В–≤–Њ—А–µ–љ–Є—П –Њ—В–љ–Њ—Б—П—В—Б—П –Ї
—В–Є–њ—Г —Н–ї–µ–Ї—В—А–Њ–ї–Є—В–Њ–≤, —А–∞—Б—В–≤–Њ—А—П—О—Й–Є—Е—Б—П —Б –≤—Л–і–µ–ї–µ–љ–Є–µ–Љ —В–µ–њ–ї–∞, –∞ —Н–ї–µ–Ї—В—А–Њ–ї–Є—В—Л, –Њ–±—А–∞–Ј—Г—О—Й–Є–µ
—Н–Љ—Г–ї—М—Б–Є–Є –≤—В–Њ—А–Њ–є –≥—А—Г–њ–њ—Л, —А–∞—Б—В–≤–Њ—А—П—О—В—Б—П —Б –њ–Њ–≥–ї–Њ—Й–µ–љ–Є–µ–Љ —В–µ–њ–ї–∞ [6, 7].
–С–Њ–ї–µ–µ
—В–Њ–љ–Ї–Њ–µ –њ—А–Њ—П–≤–ї–µ–љ–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є–є —Б–Њ—Б—В–Њ—П–љ–Є—П –≤–Њ–і—Л –≤ —Н–Љ—Г–ї—М—Б–Є—П—Е —Б—В–∞–љ–Њ–≤–Є—В—Б—П –њ–Њ–љ—П—В–љ—Л–Љ –њ—А–Є
—А–∞—Б—Б–Љ–Њ—В—А–µ–љ–Є–Є –љ–µ —Б—Г–Љ–Љ–∞—А–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П —Н–ї–µ–Ї—В—А–Њ–ї–Є—В–∞, –∞ –∞–љ–Є–Њ–љ–∞ –Є –Ї–∞—В–Є–Њ–љ–∞ –≤
–Њ—В–і–µ–ї—М–љ–Њ—Б—В–Є. –Я–Њ –Ю.–ѓ.–°–∞–Љ–Њ–є–ї–Њ–≤—Г [8, 9] —Б–ї–µ–і—Г–µ—В —А–∞–Ј–ї–Є—З–∞—В—М —Б–ї—Г—З–∞–Є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ –Є
–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ –≥–Є–і—А–∞—В–Є—А—Г—О—Й–Є—Е—Б—П –Є–Њ–љ–Њ–≤. –Я–µ—А–≤—Л–є –Є–Ј –љ–Є—Е —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–Љ—Г
—Б–≤—П–Ј—Л–≤–∞–љ–Є—О –Є–Њ–љ–∞–Љ–Є –±–ї–Є–ґ–∞–є—И–Є—Е –Ї –љ–Є–Љ –Љ–Њ–ї–µ–Ї—Г–ї –≤–Њ–і—Л —А–∞—Б—В–≤–Њ—А–∞ (–Є–Ј –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е –љ–∞–Љ–Є
—Н—В–Њ –Є–Њ–љ—Л Na+, Mg2+, Ca2+, Sr2+, Ba2+, HCO3-, SO42-). –Т–Њ –≤—В–Њ—А–Њ–Љ —Б–ї—Г—З–∞–µ (–Є–Ј
–Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е –љ–∞–Љ–Є —Н—В–Њ –Є–Њ–љ—Л Cl-, Br-, J-, NH4-, NO3-) –±–ї–Є–ґ–∞–є—И–Є–µ –Ї –Є–Њ–љ—Г –Љ–Њ–ї–µ–Ї—Г–ї—Л
–≤–Њ–і—Л —А–∞—Б—В–≤–Њ—А–∞ –±–Њ–ї–µ–µ –њ–Њ–і–≤–Є–ґ–љ—Л, —З–µ–Љ –≤ —Б–≤–Њ–±–Њ–і–љ–Њ–є –≤–Њ–і–µ. –°—Г–Љ–Љ–∞—А–љ–Њ —Б—В—А—Г–Ї—В—Г—А–љ–Њ–µ
–і–µ–є—Б—В–≤–Є–µ —Н–ї–µ–Ї—В—А–Њ–ї–Є—В–∞ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –Ј–љ–∞–Ї–∞–Љ–Є –Є –≤–µ–ї–Є—З–Є–љ–∞–Љ–Є —Н–љ–µ—А–≥–Є–є –±–ї–Є–ґ–љ–µ–є
–≥–Є–і—А–∞—В–∞—Ж–Є–Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—А—Л –∞–љ–Є–Њ–љ–∞ –Є –Ї–∞—В–Є–Њ–љ–∞ [5, 9], —З—В–Њ –њ–Њ–ї–љ–Њ—Б—В—М—О
–Њ–±—К—П—Б–љ—П–µ—В –Њ–±–љ–∞—А—Г–ґ–µ–љ–љ—Л–є –љ–∞–Љ–Є —Е–∞—А–∞–Ї—В–µ—А –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Ї—А–Є–≤—Л—Е g(r) –Є –≤–µ–ї–Є—З–Є–љ —Б—А–µ–і–љ–Є—Е
—А–∞–Ј–Љ–µ—А–Њ–≤ –≥–ї–Њ–±—Г–ї –≤–Њ–і—Л –≤ —Н–Љ—Г–ї—М—Б–Є—П—Е –љ–∞ –Њ—Б–љ–Њ–≤–µ –≤—Б–µ—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е —Н–ї–µ–Ї—В—А–Њ–ї–Є—В–Њ–≤.
–Т
–Ї–∞—З–µ—Б—В–≤–∞ –і–Њ–±–∞–≤–Њ–Ї (4,66 % –Љ–Њ–ї.) –љ–µ—Н–ї–µ–Ї—В—А–Њ–ї–Є—В–Њ–≤ (вАЬ—Б—В–∞–±–Є–ї–Є–Ј–Є—А—Г—О—Й–Є—ЕвАЭ –Є
вАЬ—А–∞–Ј—А—Г—И–∞—О—Й–Є—ЕвАЭ —Б—В—А—Г–Ї—В—Г—А—Г –≤–Њ–і—Л) –Љ—Л –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –≥–µ–Ї—Б–∞–Љ–µ—В–Є–ї—Д–Њ—Б—Д–Њ—А—В—А–Є–∞–Љ–Є–і (–У–Ь–§–Ґ), –Ї–∞—А–±–∞–Љ–Є–і (–Љ–Њ—З–µ–≤–Є–љ—Г) –Є –∞—Ж–µ—В–∞–Љ–Є–і. –Т–≤–µ–і–µ–љ–Є–µ –і–≤—Г—Е –њ–µ—А–≤—Л—Е –Є–Ј –љ–Є—Е –њ—А–Є–≤–Њ–і–Є—В –Ї
–љ–µ–Ї–Њ—В–Њ—А–Њ–Љ—Г —Г–Љ–µ–љ—М—И–µ–љ–Є—О —Б—А–µ–і–љ–Є—Е —А–∞–Ј–Љ–µ—А–Њ–≤ –≥–ї–Њ–±—Г–ї –≤–Њ–і—Л –≤ —Н–Љ—Г–ї—М—Б–Є–Є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б
—А–∞–Ј–Љ–µ—А–∞–Љ–Є –≥–ї–Њ–±—Г–ї –≤–Њ–і—Л –≤ —Н–Љ—Г–ї—М—Б–Є—П—Е –љ–∞ –Њ—Б–љ–Њ–≤–µ –Ї–∞–Ї –њ—А–µ—Б–љ–Њ–є, —В–∞–Ї –Є –њ–ї–∞—Б—В–Њ–≤–Њ–є –≤–Њ–і—Л.
–Р—Ж–µ—В–∞–Љ–Є–і, –љ–∞–Њ–±–Њ—А–Њ—В, –≤–ї–Є—П–µ—В –љ–∞ —А–∞–Ј–Љ–µ—А—Л –≥–ї–Њ–±—Г–ї –≤–Њ–і—Л –≤ —Н–Љ—Г–ї—М—Б–Є—П—Е –≤ –њ—А–Њ—В–Є–≤–Њ–њ–Њ–ї–Њ–ґ–љ—Г—О
—Б—В–Њ—А–Њ–љ—Г (—А–Є—Б. 2, 3).
|
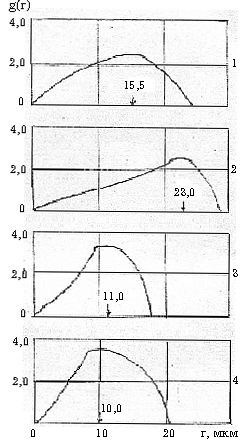
–†–Є—Б. 2. –Ъ—А–Є–≤—Л–µ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П g(r) –≥–ї–Њ–±—Г–ї –≤–Њ–і—Л –≤ 5% –≤/–љ —Н–Љ—Г–ї—М—Б–Є—П—Е, –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–љ—Л—Е –љ–∞ –Њ—Б–љ–Њ–≤–µ –њ—А–µ—Б–љ–Њ–є –≤–Њ–і—Л (1) –Є —Б –і–Њ–±–∞–≤–ї–µ–љ–Є–µ–Љ (4,66 % –Љ–Њ–ї.) –љ–µ—Н–ї–µ–Ї—В—А–Њ–ї–Є—В–Њ–≤:
2 - –∞—Ж–µ—В–∞–Љ–Є–і–∞, 3 - –У–Ь–§–Ґ, 4 - –Ї–∞—А–±–∞–Љ–Є–і–∞.
|
 
|
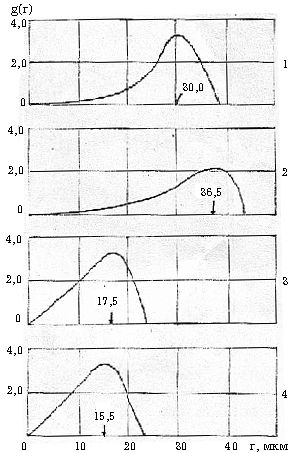
–†–Є—Б. 3. –Ъ—А–Є–≤—Л–µ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П g(r) –≥–ї–Њ–±—Г–ї –≤–Њ–і—Л –≤ 5% –≤/–љ —Н–Љ—Г–ї—М—Б–Є—П—Е, –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–љ—Л—Е
–љ–∞ –Њ—Б–љ–Њ–≤–µ –њ–ї–∞—Б—В–Њ–≤–Њ–є –≤–Њ–і—Л (1) –Є —Б –і–Њ–±–∞–≤–ї–µ–љ–Є–µ–Љ (4,66 % –Љ–Њ–ї.) –љ–µ—Н–ї–µ–Ї—В—А–Њ–ї–Є—В–Њ–≤: 2
- –∞—Ж–µ—В–∞–Љ–Є–і–∞, 3 - –У–Ь–§–Ґ, 4 - –Ї–∞—А–±–∞–Љ–Є–і–∞.
|
–Т–≤–µ–і–µ–љ–Є–µ
–≤ –њ—А–µ—Б–љ—Г—О –≤–Њ–і—Г –њ–Њ–ї–Є–∞–Ї—А–Є–ї–∞–Љ–Є–і–∞ (–Я–Р–Р) –њ–Њ–Ї–∞–Ј—Л–≤–∞–µ—В, —З—В–Њ —А–∞–Ј–Љ–µ—А—Л –≥–ї–Њ–±—Г–ї –≤–Њ–і—Л –њ–Њ
—Б—А–∞–≤–љ–µ–љ–Є—О —Б –Ї–Њ–љ—В—А–Њ–ї—М–љ—Л–Љ –Њ–њ—Л—В–Њ–Љ —Б–љ–∞—З–∞–ї–∞ —Г–Љ–µ–љ—М—И–∞—О—В—Б—П (–њ—А–Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П—Е 0,01-0,04
% –≤–µ—Б–Њ–≤–Њ–≥–Њ –Я–Р–Р –≤ –њ–µ—А–µ—Б—З–µ—В–µ –љ–∞ —З–Є—Б—В—Л–є –њ–Њ–ї–Є–∞–Ї—А–Є–ї–∞–Љ–Є–і), –∞ –Ј–∞—В–µ–Љ —Г–≤–µ–ї–Є—З–Є–≤–∞—О—В—Б—П –Є
—Б—В–∞–љ–Њ–≤—П—В—Б—П –±–Њ–ї—М—И–µ, —З–µ–Љ –≤ –њ—А–µ—Б–љ–Њ–є –≤–Њ–і–µ. –Ь–∞–Ї—Б–Є–Љ–∞–ї—М–љ—Л–µ —А–∞–Ј–Љ–µ—А—Л –≥–ї–Њ–±—Г–ї –і–Њ—Б—В–Є–≥–∞—О—В—Б—П
–њ—А–Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≤ –≤–Њ–і–µ ~0,08 % –≤–µ—Б. –Я–Р–Р. –Я—А–Є –і–∞–ї—М–љ–µ–є—И–µ–Љ —Г–≤–µ–ї–Є—З–µ–љ–Є–Є
–Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –њ–Њ–ї–Є–∞–Ї—А–Є–ї–∞–Љ–Є–і–∞ —А–∞–Ј–Љ–µ—А—Л –≥–ї–Њ–±—Г–ї –≤–Њ–і—Л –≤ —Н–Љ—Г–ї—М—Б–Є—П—Е –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ
–Є–Ј–Љ–µ–љ—П—О—В—Б—П. –≠—В–∞ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –Я–Р–Р, –Ї—Б—В–∞—В–Є, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В –њ—А–Њ–Љ—Л—Б–ї–Њ–≤–Њ–є
–Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є, —Е–∞—А–∞–Ї—В–µ—А–љ–Њ–є –љ–∞–Є–±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–Љ—Г –≤—Л—В–µ—Б–љ–µ–љ–Є—О –љ–µ—Д—В–Є –Є–Ј –њ–ї–∞—Б—В–∞.
–°–њ–Є—Б–Њ–Ї –ї–Є—В–µ—А–∞—В—Г—А—Л
–С–∞–±–∞–ї—П–љ
–У.–Р. –§–Є–Ј–Є–Ї–Њ-—Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—Ж–µ—Б—Б—Л –≤ –і–Њ–±—Л—З–µ –љ–µ—Д—В–Є. –Ь.: –Э–µ–і—А–∞, 1974.
–†–µ–Ї–Њ–Љ–µ–љ–і—Г–µ–Љ —Б–Ї–∞—З–∞—В—М –і—А—Г–≥–Є–µ —А–µ—Д–µ—А–∞—В—Л –њ–Њ —В–µ–Љ–µ: —Н–љ–µ—А–≥–Є—П —А–µ—Д–µ—А–∞—В, —И–њ–∞—А–≥–∞–ї–Ї–Є –њ–Њ –Є—Б—В–Њ—А–Є–Є.–Я—А–µ–і—Л–і—Г—Й–∞—П —Б—В—А–∞–љ–Є—Ж–∞ —А–µ—Д–µ—А–∞—В–∞ |
1
2
3 |
–°–ї–µ–і—Г—О—Й–∞—П —Б—В—А–∞–љ–Є—Ж–∞ —А–µ—Д–µ—А–∞—В–∞



