
Горячие точки современной геронтологии
Категория реферата: Рефераты по медицине
Теги реферата: реферат великая, скачать шпаргалки по истории
Добавил(а) на сайт: Мамин.
Предыдущая страница реферата | 1 2 3 4 5 | Следующая страница реферата
Рис. 3. Влияние метформина (цветная кривая) на продолжительность жизни
и развитие спонтанных опухолей (справа) у самок трансгенных мышей HER-2/neu [18].
Стареющие клетки: хорошие граждане, но плохие соседи
|
Не обольщайся призраком покоя: Бывает жизнь обманчива на вид. Настанет час, и утро роковое Твои мечты, сверкая, ослепит. Николай Заболоцкий |
В 1971 г. научный cотрудник Института биохимической физики РАН А.М.Оловников, используя данные о принципах синтеза ДНК в клетках, предложил гипотезу маргинотомии, объясняющую механизм работы счетчика клеточных делений. Согласно его гипотезе, ДНК-полимераза при матричном синтезе полинуклеотидов полностью не воспроизводит линейную матрицу, и реплика всегда получается короче в ее начальной части. Таким образом, при каждом делении клетки ее ДНК укорачивается, что ограничивает пролиферативный потенциал клеток и, очевидно, служит “счетчиком” числа делений и, соответственно, продолжительности жизни клетки в культуре. Открытие в 1985 г. фермента теломеразы, достраивающего укороченную теломеру в половых клетках и клетках опухолей, обеспечивая их бессмертие, стало блестящим подтверждением гипотезы Оловникова.
В последние годы достигнут значительный прогресс в изучении роли теломер в старении. Дисфункция теломер (связана ли с укорочением, прямым повреждением или ассоциированным с теломерой дефектным белком) может приводить к трем последствиям: старению клетки, ее гибели (факторы, подавляющие неопластический процесс) или нестабильности генома, которое может способствовать злокачественной трансформации клетки.
Старение клетки рассматривают как один из ее защитных механизмов при дисфункции теломер, поскольку оно останавливает пролиферацию, тем самым блокируя канцерогенез (“хорошие граждане”) [16]. В течение жизни в организме накапливаются соматические мутации, некоторые из них могут инактивировать гены, участвующие в клеточном старении. Кроме того, потеря гетерозиготности и мутации в генах-супрессорах (р53 и Rb) и онкогенах (например, ras) встречаются даже в нормальных клетках. Другой защитный механизм клетки с дисфункцией теломер, в который вовлечен интактный р53, - апоптоз. В клетках, где накапливаются мутации в гене р53 или в компонентах его регуляции, развивается нестабильность генома, повышающая вероятность злокачественной трансформации. Потеря дистальных областей теломер связана с уменьшением пролиферативной жизни клеток как in vitro, так и in vivo. Анализ данных по укорочению теломер в 15 различных тканях человека показал, что в год теломеры теряют от 20 до 60 пар оснований.
В настоящее время активно развивается гипотеза о важной роли укорочения теломер и соответственно реактивации теломеразы при старении и канцерогенезе. В опухолях человека появление бессмертных клеток (иммортализация) почти всегда обусловлено подавлением гена каталитической субъединицы теломеразы (hTERT). Множественность механизмов, подавляющих или регулирующих активность этого фермента, может объяснить исключительную редкость спонтанной иммортализации нормальных клеток человека. С другой стороны, введение субъединицы hTERT стимулирует рост различных типов клеток человека без последующего развития опухолевого роста. Вероятно, основная функция супрессорного гена p53 состоит в остановке роста в ответ на потерю теломер в старых клетках. Этой гипотезе не противоречат данные о поведении большинства опухолей, в которых этот ген мутирован, и объясняют характеристики редких типов опухолей, в которых функция p53 сохранена.
Недавно показано, что in vitro старые фибробласты человека стимулируют пролиферацию предраковых и злокачественных эпителиальных клеток, которые способны образовывать опухоли при прививке голым мышам (“плохие соседи”) [17]. У фибробластов на более ранних пассажах (пресенильных) эта способность менее выражена. Несмотря на довольно убедительные аргументы в пользу связи между старением клеток, биологией теломеры и раком человека, данные о роли клеточного старения в старении человека довольно противоречивы и требуют дальнейших исследований.
Увеличение продолжительности жизни и риск рака
|
Все равно, по какой дороге идти. Куда-нибудь ты наверняка попадешь, если будешь идти достаточно долго. Льюис Кэррол. Приключения Алисы в Стране чудес |
Расчеты показывают, что у человека с продолжительностью жизни 70 лет, крысы (2.5-3 года) и мыши (2-2.5 года) частота новообразований одинакова и составляет 30% [3, 19]. Однако при нормализации по количеству клеток в организме оказывается, что мышь более склонна к развитию опухолей, чем человек. Этот феномен склонны объяснять тем, что в соматических клетках мыши теломераза более активна, чем в клетках человека, чему соответствует значительно большая длина теломер у мыши по сравнению с человеком. Вместе с тем видовая продолжительность жизни млекопитающих соотносится с эффективностью репарации ДНК и устойчивостью их клеток к окислительному стрессу. Так, в ДНК человека восстановление гуанина, алкилированного канцерогенными нитрососоединениями, в сотни раз выше, чем у мыши, что связано с большей резистентностью человека к этим агентам. Оказалось, что эффективность репарации вызываемых канцерогеном повреждений в ДНК различных органов связана с продолжительностью жизни мышей. Анализ данных о частоте рака у генетически модифицированных животных с увеличенной продолжительностью жизни говорит о снижении у них частоты злокачественных новообразований [3].
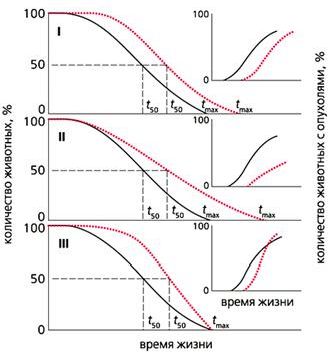
Рис. 4. Влияние трех типов геропротекторов (цветные кривые) на продолжительность жизни животных
и частоту спонтанных опухолей (на врезке).
I - продолжительность жизни всех особей увеличивается, скорость старения не меняется, новообразования развиваются позднее, чем в контрольной группе, но с такой же частотой;
II - скорость старения снижается, частота новообразований уменьшается;
III - продолжительность жизни не меняется, а скорость старения и количество новообразований растет.
tmax - максимальная продолжительность жизни, t50 - время полужизни.
Рекомендуем скачать другие рефераты по теме: бесплатные рефераты скачать, информационные технологии реферат.
Предыдущая страница реферата | 1 2 3 4 5 | Следующая страница реферата