
Билеты по химии 10 класс
Категория реферата: Рефераты по науке и технике
Теги реферата: выборы реферат, решебник по математике 6 виленкин
Добавил(а) на сайт: Gershel'man.
Предыдущая страница реферата | 10 11 12 13 14 15 16 17 18 19 20 | Следующая страница реферата
NaCI + НОН — ни один из ионов соли с водой не вза-имодействет. Реакция среды нейтральная.
II. Соль образована сильным основанием и слабой кислотой.
![]() - реакция среды щелочная.
- реакция среды щелочная.
Гидролиз солей, образованных сильным основанием и слабой кислотой, заключается в присоединении анионами кислотного остатка ионов водорода и накоплении в растворе гидроксид-ионов, образующихся при диссоциации воды.
Теперь выясним, почему раствор хлорида алюминия приобрел кислую реакцию среды. В растворе АlСl3 диссоциирует на ионы:
![]()
Столкновение ионов Н+ и С– к образованию соединения не приводит. Из имеющихся в растворе ионов малодиссоциирующий продукт образуют ионы Аl3+ и ОН–. Связывание ионов ОН– в малодиссоциирующий ион АlOН2+ (К= 1,38 • 10–9) вызывает дальнейший распад молекул воды на ионы:
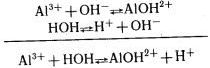
Таким образом, в растворе хлорида алюминия осуществляется реакция, в результате которой появляется избыток ионов Н+, т. е. раствор приобретает кислую реакцию. Подобным образом ведут себя в растворах все соли, образованные слабым основанием и сильной кислотой.
III. Соль образована слабым основанием и сильной кислотой.
![]() — реакция среды кислая.
— реакция среды кислая.
Гидролиз соли, образованной слабым основанием и сильной кислотой, заключается в присоединении катионами металла гидроксид-ионов и накоплении в растворе ионов водорода, образующихся при диссоциации воды. Гидролиз хлорида алюминия можно выразить уравнением реакции:
![]()
Реакция среды зависит от сравнительной силы кислоты и основания. В некоторых случаях гидролиз идет до конца:
![]()
Коррозия металлов (химическая и электрохимическая). Способы предупреждения коррозии.
Разрушение металлов и сплавов вследствие химического взаимодействия их с окружающей средой называются коррозией металлов.
Коррозию, вызванную непосредственным химическим взаимодействием между металлом и окружающей средой, называют химической коррозией.
Химическая коррозия — окисление металла без возникновения гальванической пары. Газовая коррозия — при t > 600°С:
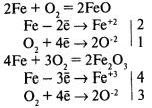
Коррозию, сопровождающуюся возникновением электрического тока за счет появления гальванической пары, называют электрохимической коррозией.
Электрохимическая коррозия – разрушение металла в электролите с возникновением гальванической пары.
![]() – ионы выходят в раствор, электроны
перемещаются к менее активному металлу, например к меди.
– ионы выходят в раствор, электроны
перемещаются к менее активному металлу, например к меди.
![]() – разряжаются на менее активном металле, например на меди.
– разряжаются на менее активном металле, например на меди.
Одним из наиболее широко распространенных видов электрохимической коррозии является ржавление обычной стали в водной среде и на воздухе. На поверхности металлических изделий всегда имеется пленка влаги, адсорбированной из воздуха. Она является электролитом, так как в ней растворены различные газы (СО2, SO2 и др.). Зерна карбида железа Fe3С химически менее активны, чем железо. Поэтому возникают микрогальваническис элементы: зерна Fe3С играют роль катодов, а зерна чистого железа — роль анодов. Железо разрушается — оно ржавеет. Протекающие при этом процессы весьма сложные. Укажем лишь суммарное уравнение реакции:
Рекомендуем скачать другие рефераты по теме: шпаргалки по педагогике, доклад по обж.
Предыдущая страница реферата | 10 11 12 13 14 15 16 17 18 19 20 | Следующая страница реферата