
Электрохимические методы защиты металлов от коррозии
Категория реферата: Рефераты по науке и технике
Теги реферата: биология 6 класс, конспект
Добавил(а) на сайт: Jakimov.
Предыдущая страница реферата | 1 2 3 4
![]() =
=![]() =
=![]() =2,
=2,
а степень защиты достигает 50%
![]() =
=![]()
![]() =
=![]() .
.
Внешний ток ![]() , необходимый для смещения потенциала до значения
, необходимый для смещения потенциала до значения ![]() , представляет собой разницу между катодным и анодным токами
, представляет собой разницу между катодным и анодным токами
![]()
(его величина на рис.4 выражена прямой ав). По мере увеличения внешнего тока потенциал смещается в более отрицательную
сторону, и скорость коррозии должна непрерывно падать. Когда потенциал корродирующего металла достигает равновесного потенциала анодного процесса ![]() , скорость коррозии делается равной нулю (
, скорость коррозии делается равной нулю (![]() ), коэффициент торможения – бесконечности, а степень защиты 100%. Плотность тока, обеспечивающая полную катодную защиту, называется
защитным током
), коэффициент торможения – бесконечности, а степень защиты 100%. Плотность тока, обеспечивающая полную катодную защиту, называется
защитным током ![]() . Его величине на рис.4 соответствует
отрезок cd. Величина защитного тока не зависит от особенностей протекания данной анодной реакции, в частности от величины сопровождающей ее
поляризации, а целиком определяется катодной поляризационной кривой. Так, например, при переходе от водородной деполяризации к кислородной сила защитного
тока уменьшается и становится равной предельному диффузному току (отрезок cd / на рис.4).
. Его величине на рис.4 соответствует
отрезок cd. Величина защитного тока не зависит от особенностей протекания данной анодной реакции, в частности от величины сопровождающей ее
поляризации, а целиком определяется катодной поляризационной кривой. Так, например, при переходе от водородной деполяризации к кислородной сила защитного
тока уменьшается и становится равной предельному диффузному току (отрезок cd / на рис.4).
Защита металла катодной поляризацией применяется для повышения стойкости металлических сооружений в условиях подземной (почвенной) и морской коррозии, а также при контакте металлов с агрессивными химическими средами. Она является экономически оправданной в тех случаях, когда коррозионная среда обладает достаточной электропроводностью, и потери напряжения (связанные с протеканием защитного тока), а следовательно, и расход электроэнергии сравнительно невелик. Катодная поляризация защищаемого металла достигается либо наложением тока от внешнего источника (катодная защита), либо созданием макрогальванической пары с менее благородным металлом (обычно применяются алюминий, магний, цинк и их сплавы). Он играет здесь роль анода и растворяется со скоростью, достаточной для создания в системе электрического тока необходимой силы (протекторная защита). Растворимый анод при протекторной защите часто называют “жертвенным анодом”.
Катодная защита обычно связана с защитой черных металлов, так как из них изготавливается подавляющая часть объектов работающих под землей и при погружении в воду, например трубопроводы, свайные основания, пирсы, эстакады, суда и др. В качестве материала для расходуемых анодов-протекторов во всем мире широко применяется магний. Обычно он используется в виде сплавов с содержанием 6% алюминия, 3% цинка и 0,2% марганца; эти добавки предотвращают образование пленок, которые снижают скорость растворения металла. Выход защитного тока всегда меньше 100%, так как магний корродирует и на нем выделяется водород. Применяется также алюминий, легированный 5% цинка, но разность потенциалов с железом для сплава значительно меньше, чем для магниевого сплава. Она близка к разности потенциалов для металлического цинка, который также применяется для защиты при условии, что путем соответствующего легирования на анодах предотвращается пленкообразование, связанное с обычным для цинка загрязнением примесями железа Выбор материала для анодов - сложная задача. В почвах или других средах низкой проводимости необходима большая разность потенциалов, поскольку падение iR между электродами весьма велико, в то время как в средах высокой проводимости возможна более экономичная для использования малая разность потенциалов. Важными переменными являются расположение электродов, рассеивающая способность среды, т. е. ее способность обеспечить одинаковую плотность тока на всех участках защищаемой поверхности, а также поляризационные характеристики электродов. Если электроды погружены в почву, которая по каким – либо причинам неприемлема, например агрессивна по отношению к анодам, то обычно практикуется окружать последние ложем из нейтрального пористого проводящего материала, называемого засыпкой.
Применение для катодной защиты метода приложения тока облегчает регулирование системы и часто дешевле, чем использование анодов – протекторов, которые, конечно, нуждаются в регулярных заменах.
На практике катодная защита редко применяется без дополнительных мероприятий. Требуемый для полной защиты ток обычно бывает чрезмерно велик, и помимо дорогостоящих электрических установок для его обеспечения следует иметь в виду, что такой ток часто будет вызывать вредный побочный эффект, например чрезмерное защелачивание. Поэтому катодная защита применяется в сочетании с некоторыми видами покрытий. Требуемый при этом ток мал и служит только для защиты обнаженных участков поверхности металла.
Явление пассивности.Давно известно, что скорость коррозии многих металлов часто значительно меньше в растворах сильных окислителей, чем в растворах окислителей более слабых. Сюда относятся такие металлы, как железо, хром, никель, титан, цирконий, алюминий и многие другие. Резкое уменьшение скорости коррозии (на несколько порядков) в сильных окислителях, казалось бы противоречащее термодинамическим свойствам металла и окислителя, называется пассивацией, а состояние металла – пассивным.
Некоторые металлы находятся в пассивном (или близком к пассивному) состоянии даже в таких слабых окислителях, как вода. Это дает возможность практически использовать в качестве конструкционных материалов магний, титан, алюминий и многие другие.
М.В. Ломоносов был, по-видимому, первым исследователем, обратившим внимание на пассивность железа в концентрированной азотной кислоте. Железу посвящены наблюдения М. Фарадея и Х. Шенбейна. М. Фарадей сделал удивительную по научной дальновидности попытку объяснить пассивность железа образованием на поверхности слоя (пленки) окисла или же существованием поверхностных атомов металла в таком состоянии, которое равноценно окислению.
Очень большое практическое значение пассивности, часто определяющее возможность получения сплавов, химически стойких в агрессивных средах, вызвало огромное количество исследований, посвященных изучению пассивного состояния. Если отбросить некоторые несущественные различия, высказываемые на основании сопоставления экспериментальных данных, сказав, что пассивное состояние обусловлено образованием очень тонкой пленки окисла, представляющего собой отдельную фазу, или слоя хемисорбированного кислорода, а может быть и других частиц. Ограничимся представлением о некотором кислородном «барьере», образующемся на поверхности металла в подходящем окислителе и сильно тормозящем анодный процесс.
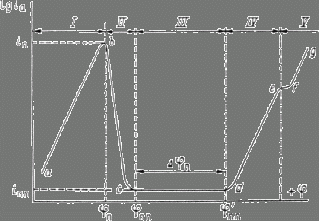
Рис. 6. Полная анодная поляризационная кривая: I – активное растворение; II – переход в пассивное состояние; III – пассивность; IV – перепассивация; V – выделение кислорода.
На рис.5 приведена анодная кривая, которую мы подробно рассмотрим. Активное растворение
продолжается до потенциала, отвечающего точке b. При этом ток равен критическому току пассивации ![]() , а потенциал обозначен символом
, а потенциал обозначен символом ![]() . На участке bс (в интервале потенциалов
. На участке bс (в интервале потенциалов ![]() -
- ![]() ) происходит пассивация.
) происходит пассивация. ![]() и
и ![]() можно
назвать потенциалом и током полной (наилучшей) запассивированности. Это название не вполне точно, так как на реальных поляризационных кривых линия cd
редко бывает строго горизонтальной; но сравнительно небольшими вариациями тока
можно
назвать потенциалом и током полной (наилучшей) запассивированности. Это название не вполне точно, так как на реальных поляризационных кривых линия cd
редко бывает строго горизонтальной; но сравнительно небольшими вариациями тока ![]() в интервале cd часто можно пренебречь. Потенциал
в интервале cd часто можно пренебречь. Потенциал ![]() и ток
и ток ![]() являются
важными характеристиками электрода, показывающими, насколько легко металл переходит в пассивное состояние. Чем отрицательнее
являются
важными характеристиками электрода, показывающими, насколько легко металл переходит в пассивное состояние. Чем отрицательнее ![]() и чем меньше
и чем меньше ![]() , тем легче наступает пассивность. Интервал потенциалов
, тем легче наступает пассивность. Интервал потенциалов ![]() отвечает условиям, в которых сохраняется пассивное состояние. Чем больше
отвечает условиям, в которых сохраняется пассивное состояние. Чем больше ![]() , тем в более широких пределах изменение потенциала будет сохранять пассивное состояние. Выше потенциала
, тем в более широких пределах изменение потенциала будет сохранять пассивное состояние. Выше потенциала ![]() скорость окисления снова увеличивается ( участок cе ) и металл оказывается в области перепассивации или в транспассивном состоянии.
Иными словами, отклонение значения потенциала от равновесного значения называется перепассивацией. При еще более высоком потенциале становится возможным процесс
окисления ионов гидроксила и выделение кислорода: 4ОН-→ 2Н2О + О2 + 4е. Это соответствует участку fg. Если этот
последний процесс определяет кинетику анодной реакции, то угловой коэффициент прямой fg соответствует окислению ионов ОН-.
скорость окисления снова увеличивается ( участок cе ) и металл оказывается в области перепассивации или в транспассивном состоянии.
Иными словами, отклонение значения потенциала от равновесного значения называется перепассивацией. При еще более высоком потенциале становится возможным процесс
окисления ионов гидроксила и выделение кислорода: 4ОН-→ 2Н2О + О2 + 4е. Это соответствует участку fg. Если этот
последний процесс определяет кинетику анодной реакции, то угловой коэффициент прямой fg соответствует окислению ионов ОН-.
При изменение потенциала в обратном направлении кривая, вообще говоря, имеет такой же ход. В
таком случае ![]() будет потенциалом начала потери пассивности (депассивации).
Его иногда называют фладе-потенциало (
будет потенциалом начала потери пассивности (депассивации).
Его иногда называют фладе-потенциало (![]() ) по имени исследователя, изучавшего депассивацию железа.
) по имени исследователя, изучавшего депассивацию железа.
В настоящее время вопрос сводится к изучению природы защитных образований на металле, в которых обычно участвует кислород.
При более высоком потенциале становится возможным процесс выделения кислорода:
2Н2О – 4е = 2Оадс + 4Н+
О2 = 2Оадс
Скачали данный реферат: Proskura, Пивоваров, Валентин, Яздовский, Vitinskij, Agliullin.
Последние просмотренные рефераты на тему: контрольная работа 3, шпори, реферат египет, доклад на тему.
Предыдущая страница реферата | 1 2 3 4