
Сероводород
Категория реферата: Рефераты по науке и технике
Теги реферата: виды шпор, диплом купить
Добавил(а) на сайт: Глухов.
1 2 | Следующая страница реферата
Сероводород.
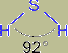 Информация общего характера.
Информация общего характера.
Молекула Н2S имеет структуру равнобедренного треугольника с атомом серы в центре [d(HS) = 133 пм, угол HSH = 92°]. Сероводород представляет собой бесцветный и весьма ядовитый газ, уже 1 часть которого на 100 000 частей воздуха обнаруживается по его характерному запаху (тухлых яиц).
В жидком состоянии Н2S проводит электрический ток несравненно хуже, чем вода, так как собственная его электролитическая диссоциация ничтожно мала: [SH3+] [HS-] = 3·10-33. Жидкий, сероводород имеет низкую диэлектрическую проницаемость (e = 6 при 0 °С) и как растворитель похож скорее на органические жидкости, чем на воду. Так, он практически не растворяет лед. Твердый Н2S имеет строение плотной упаковки с 12 ближайшими соседями у каждой молекулы (т. е. совершенно иное, чем лед). Теплота плавления сероводорода равна 2,5 кДж/моль, а теплота испарения 18,8 кДж/моль.
tпл -85,54 °С, tкип -60,35 °С; при 0 °С сжижается под давлением 1 МПа. Восстановитель.
Химические свойства.
Сероводород взаимодействует с основаниями:
H2S + 2NaOH = Na2S + 2H2O
H2S проявляет очень сильные восстановительные свойства:
H2S-2 + Br2 = S0 + 2HBr
H2S-2 + 2FeCl3 = 2FeCl2 + S0 + 2HCl
H2S-2 + 4Cl2 + 4H2O = H2S+6O4 + 8HCl
3H2S-2 + 8HNO3(конц) = 3H2S+6O4 + 8NO + 4H2O
H2S-2 + H2S+6O4(конц) = S0 + S+4O2 + 2H2O
(при нагревании
реакция идет по - иному:
H2S-2 + 3H2S+6O4(конц) =-t°=
4S+4O2 + 4H2O)
Серебро при контакте с сероводородом чернеет:
4Ag + 2H2S + O2 = 2Ag2S + 2H2O
Качественная реакция на сероводород и растворимые сульфиды - образование темно-коричневого (почти черного) осадка PbS:
H2S + Pb(NO3)2 = PbS(осадок) + 2HNO3
Na2S + Pb(NO3)2 = PbS(осадок) + 2NaNO3
Pb2+ + S2- = PbS(осадок)
Один объём воды растворяет в обычных условиях около 3 объемов сероводорода (с образованием приблизительно 0,1 М раствора (сероводородной воды)). При нагревании растворимость понижается. Подожженный на воздухе сероводород сгорает по одному из следующих уравнений:
2 Н2S + 3 O2 = 2 H2O + 2 SO2 + 1125 кДж (при избытке кислорода)2 Н2S + O2 = 2 H2O + 2 S + 531 кДж (при недостатке кислорода).
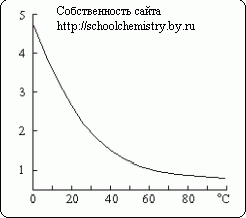
Растворимость сероводорода (объемы на 1 объём воды).
Легко окисляется сероводород и в растворе: при стоянии на воздухе сероводородная вода постепенно мутнеет вследствие выделения серы (по второй из приведенных выше реакций). Бром и йод восстанавливаются до НВr и HI. Аналогично действует он и на многие другие вещества. Сероводород является, таким образом, сильным восстановителем.
В водном растворе Н2S ведёт себя как весьма слабая кислота. Средние соли (с анионом S2-) называются сульфидами, кислые (с анионом HS-) - гидросульфидами. Несмотря на бесцветность самих ионов S2- и HS-, многие соли сероводорода окрашены в характерные цвета. Подавляющее большинство сульфидов практически нерастворимо в воде. А большая часть гидросульфидов хорошо растворима (но известна лишь в растворе).
Рекомендуем скачать другие рефераты по теме: строительные рефераты, менеджмент.
1 2 | Следующая страница реферата