
Фосфор и его соединения
Категория реферата: Биология и химия
Теги реферата: курсовики скачать бесплатно, шпаргалки по химии
Добавил(а) на сайт: Фёдоров.
Предыдущая страница реферата | 1 2 3 4 5 6 7 8 | Следующая страница реферата
Химические свойства
Все химические свойства кислотных оксидов: реагирует с водой, основными оксидами и щелочами
1) P2O5 + H2O ®2HPO3 (метафосфорная кислота)
P2O5 + 2H2O ® H4P2O7 (пирофосфорная кислота)
P2O5 + 3H2O ® 2H3PO4 (ортофосфорная кислота)
2) P2O5 + 3BaO ® Ba3(PO4)2
В зависимости от избытка щелочи образует средние и кислые соли:
![]()
![]() гидрофосфат натрия
гидрофосфат натрия
![]() дигидрофосфат натрия
дигидрофосфат натрия
Благодаря исключительной гигроскопичности оксид фосфора (V) используется в лабораторной и промышленной технике в качестве осушающего и дегидратирующего средства. По своему осушающему действию он превосходит все остальные вещества. От безводной хлорной кислоты отнимает химически связанную воду с образованием ее ангидрида:
![]()
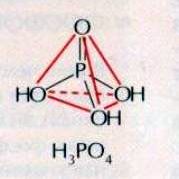 Ортофосфорная кислота.
Ортофосфорная кислота.
Известно несколько кислот, содержащих фосфор. Важнейшая из них — ортофосфорная кислота Н3РО4 (Рис.5).
Безводная ортофосфорная кислота представляет собой светлые прозрачные кристаллы, при комнатной температуре расплывающиеся на воздухе. Температура плавления 42,350С. С водой фосфорная кислота образует растворы любых концентраций.
Ортофосфорной кислоте соответствует следующая структурная формула:
![]()
![]() НО ОН
НО ОН
![]()
![]()
![]() Р
Р
О ОН
В лаборатории ортофосфорную кислоту получают окислением фосфора 30%-ной азотной кислотой:
![]()
В промышленности ортофосфорную кислоту получают двумя способами: экстракционным и термическим.
1. В основе экстракционного метода лежит обработка измельченных природных фосфатов серной кислотой:
![]()
Рекомендуем скачать другие рефераты по теме: документ реферат, конспект лекций.
Предыдущая страница реферата | 1 2 3 4 5 6 7 8 | Следующая страница реферата