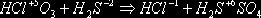|
4 окисление – восстановитель
5 восстановление - окислитель
|
Согласно
принципу электронного баланса количества молекул окислителя и восстановителя
нужно взять такими, чтобы числа принимаемых и отдаваемых электронов были
равными. Для этого находится общее кратное, а затем делится на число отдаваемых
или приобретаемых электронов; полученные коэффициенты ставятся соответственно
перед молекулой восстановителя и окислителя. Из этой схемы видно, что 4
молекулы NH3 отдают 20 электронов, которые принимаются 5 молекулами О2. Коэффициенты
электронного баланса называются основными коэффициентами. Они никаким
изменениям не подлежат:
4NH3
+ 5O2 ®
NO + H2O.
Все
остальное уравнивается в соответствии с их величиной:
4NH3
+ 5O2 ®
4NO + 6H2O.
При
окислении сульфида мышьяка As2S3 азотной кислотой HNO3 образуются мышьяковистая
кислота H3AsO4, серная H2SO4 и оксид азота NO.
Составим
схему реакции, указывая СО над символами тех элементов, у которых в процессе
реакции они изменяются:
As2+3S3-2 + HN+5O3 ® H3As+5O4 + H2S+6O4 + N+2O.
Подсчитаем
количество электронов, отдаваемых молекулой восстановителя и принимаемых
молекулой окислителя. Мышьяк изменяет СО от +3 до +5, отдавая 2 электрона. Два
атома в молекуле мышьяка As2S3 отдадут 4 электрона. Сера меняет СО от -2 до +6, отдавая 8 электронов. Три атома серы этой молекулы отдают 24 электрона. Всего
одна молекула As2S3 отдает 28 электронов. Принимает электроны азот в HNO3, изменяя СО от +5 до +2. Следовательно, каждая молекула HNO3 принимает 3
электрона. Запишем это в виде схемы:
|
As2+3S3-2 - 28ē
= 2As+5 + 3S+6 (окисление)
84
N+5 + 3ē = N2+ (восстановление)
|
3
28
|
Очевидно, что для соблюдения электронного баланса надо взять 3 молекулы As2S3 (3·28=84) и
28 молекул HNO3 (3·28=84), все остальные коэффициенты уравниваются в
соответствии с этими основными коэффициентами:
3As2S3 + 28HNO3 => 6H3AsO4 +
9H2SO4 + 28NO.
Подсчет
атомов водорода показывает, что в левой части их 28, а в правой – 36. Кислорода
в правой части 84 атома, в правой – 88. Если водород или кислород не входят в
уравнение реакции в виде простых веществ, то они уравниваются добавлением
нужного количества молекул воды в ту часть уравнения, где их недостает. Поэтому
подсчет атомов кислорода или водорода проводят в последнюю очередь, причем
уравнивание водорода добавлением молекул воды приводит к автоматическому
уравниванию кислорода и наоборот. Если водород или кислород входят в уравнение
реакции в виде простых веществ, то их необходимо уравнивать независимо друг от
друга.
Окончательно
рассматриваемое уравнение реакции будет иметь вид:
3As2S3 + 28HNO3+ 4Н2О = 6H3AsO4+ 9H2SO4 + 28NO.
Если
числа электронов, отдаваемых молекулой восстановителя и принимаемых молекулой
окислителя, имеют общий делитель, то на него можно сократить основные
коэффициенты, например: