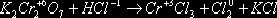|
4
3
|
(восстановление)
(окисление)
|
Наибольший
общий делитель равен 2. Коэффициенты в уравнении будут
4HСlO3
+ 3H2S = 4HCl + 3H2SO4.
Электронный
баланс в данном случае 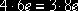 .
.
4.
Если число участвующих в реакции атомов нечетное, а в результате ее должно
получиться четное число атомов хотя бы одного из изменяющихся СО элементов, то
основные коэффициенты удваиваются:
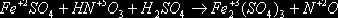
|
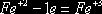
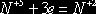
|
3
3
1
|
6
2
|
(окисление)
(восстановление)
|
6FeSO4 + 2HNO3 + 3H2SO4 = 3Fe2(SO4)3
+ 2NO + 4H2O.
В
рассмотренном примере в протекании окислительно-восстановительной реакции
принимает участие серная кислота. Она необходима для связывания образовавшегося
трехвалентного железа. Нужное количество молекул H2SO4 определяется после
расстановки коэффициентов перед продуктами реакции в соответствии с основными
коэффициентами в левой части уравнения. Водород или кислород уравниваются в
последнюю очередь добавлением молекул воды.
5.
Окислитель или восстановитель, кроме основной окислительно-восстановительной
реакции, расходуется также на связывание образующихся продуктов реакции.
Например: