
Молекулярно-кинетическая теория
Категория реферата: Рефераты по математике
Теги реферата: решебник по русскому класс, реферати українською
Добавил(а) на сайт: Мамелфа.
Предыдущая страница реферата | 1 2 3 4 5 6 7 8 9 10 | Следующая страница реферата
Здесь
введена величина ![]() – средняя
квадратичная скорость, равная корню квадратному из суммы квадратов всех
скоростей, делённой на число молекул:
– средняя
квадратичная скорость, равная корню квадратному из суммы квадратов всех
скоростей, делённой на число молекул:
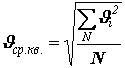 . (10)
. (10)
Тогда
![]() , (11)
, (11)
где
n ![]() –концентрация
молекул.
–концентрация
молекул.
Это уравнение называется основным уравнением молекулярно-кинетической теории идеального газа.
Получим связь давления со средней кинетической энергией поступательного движения молекулы
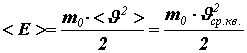 . (12)
. (12)
Из
формулы (11) 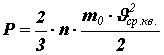 , следовательно:
, следовательно:
![]() . (13)
. (13)
Таким образом, давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы. Это утверждение можно считать другой формулировкой основного уравнения молекулярно-кинетической теории идеального газа.
Закон Дальтона.
Рассмотрим газ, состоящий из молекул различных веществ, который находится в объёме V. Вследствие хаотического теплового движения молекулы каждой компоненты смеси будут распределены по объёму равномерно, т.е. так как если бы остальные компоненты газа отсутствовали. Из–за постоянных соударений молекул друг с другом, сопровождающихся частичным обменом между ними импульсами и энергиями, в смеси устанавливается тепловое равновесие. Всё это приводит к тому, что давление каждой из компонент смеси не будет зависеть от присутствия остальных.
Тогда результирующее давление определяется суммарным давлением всех компонентов, т.е. для смеси газов справедлив закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений входящих в нее газов.
![]() , (14)
, (14)
где k – номер газовой компоненты в смеси, Pk – ее парциальное давление, т.е. то давление, которое имел бы k–ый газ, если бы только он один занимал весь объём, занимаемый смесью.
Средняя квадратичная скорость молекул.
Из основного уравнения молекулярно-кинетической теории можно получить формулу для расчета средней квадратичной скорости молекул
![]() .
.
Произведение массы одной молекулы m0 на число молекул в единице объема n равно плотности вещества r : = r m0×n.
Таким
образом, ![]() . Отсюда
следует, что
. Отсюда
следует, что
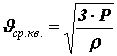 . (15)
. (15)
кспериментальные газовые законы
Изопроцессы. Законы Бойля-Мариотта, Гей-Люссака, Шарля.
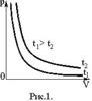
Всякое изменение состояния газа называется термодинамическим процессом.
Рекомендуем скачать другие рефераты по теме: методы курсовой работы, шарарам ответы.
Предыдущая страница реферата | 1 2 3 4 5 6 7 8 9 10 | Следующая страница реферата