
Молекулярно-кинетическая теория
Категория реферата: Рефераты по математике
Теги реферата: решебник по русскому класс, реферати українською
Добавил(а) на сайт: Мамелфа.
Предыдущая страница реферата | 1 2 3 4 5 6 7 8 9 10 | Следующая страница реферата
Простейшими процессами в идеальном газе являются изопроцессы. Это процессы, при которых масса газа и один из его параметров состояния (температура, давление или объем) остаются постоянными.
Изопроцесс, протекающий при постоянной температуре, называется изотермическим.
Экспериментально Р. Бойлем и Э. Мариоттом было установлено, что при постоянной температуре произведение давления газа на объем для данной массы газа есть величина постоянная (закон Бойля–Мариотта):
![]() (16)
(16)
Графически этот закон в координатах РV изображается линией, называемой изотермой (рис.1).
Изопроцесс, протекающий в идеальном газе, в ходе которого давление остается постоянным, называется изобарным.
Зависимость объема газа от его температуры при постоянном давлении была установлена Л. Гей-Люссаком, который показал, что объем газа данной массы при постоянном давлении возрастает линейно с увеличением температуры (закон Гей-Люссака):
V = V0·(1 + ·t), (17)
где V – объем газа при температуре t, °С; V0 – его объем при 0°С.
Величина
![]() называется
температурным коэффициентом объемного расширения. Для всех газов =
(1/273°С–1). Следовательно,
называется
температурным коэффициентом объемного расширения. Для всех газов =
(1/273°С–1). Следовательно,
V
= V0·(1 +![]() ·t). (18)
·t). (18)
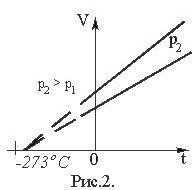
Графически зависимость объема от температуры изображается прямой линией – изобарой (рис. 2). При очень низких температурах (близких к – 273°С) закон Гей–Люссака не выполняется, поэтому сплошная линия на графике заменена пунктиром.
Изопроцесс, протекающий в газе, при котором объем остается постоянным, называется изохорным.
Исследования зависимости давления данной массы газа от температуры при неизменном объеме были впервые проведены французским физиком Шарлем. Им было установлено, что давление газа данной массы при постоянном объеме возрастает линейно с увеличением температуры (закон Шарля):
P
= P0(1+![]() t). (19)
t). (19)
Здесь P – давление газа при температуре t, °С; P0 – его давление при 0 °С.
Величина
![]() называется
температурным коэффициентом давления. Ее значение не зависит от природы газа;
для всех газов
называется
температурным коэффициентом давления. Ее значение не зависит от природы газа;
для всех газов ![]() = 1/273 °С–1.
Таким образом,
= 1/273 °С–1.
Таким образом,
P
= P0(1 +![]() ·t). (20)
·t). (20)
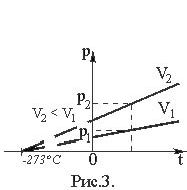
Графическая зависимость давления от температуры изображается прямой линией – изохорой (Рис. 3).
Абсолютная шкала температур.
Если изохору продолжить в область отрицательных температур, то в точке пересечения с осью абсцисс имеем
P
= P0(1 +![]() ·t) = 0. (21)
·t) = 0. (21)
Отсюда температура, при которой давление идеального газа обращается в нуль, t = –273°С (точнее,–273,16°С). Эта температура выбрана в качестве начала отсчета термодинамической шкалы температур, которая была предложена английским ученым Кельвиным. Эта температура называется нулем Кельвина (или абсолютным нулем).
Рекомендуем скачать другие рефераты по теме: методы курсовой работы, шарарам ответы.
Предыдущая страница реферата | 1 2 3 4 5 6 7 8 9 10 | Следующая страница реферата