
Галогены
Категория реферата: Рефераты по науке и технике
Теги реферата: бесплатные курсовые работы, характеристика реферата
Добавил(а) на сайт: Агапия.
Предыдущая страница реферата | 1 2 3 4 | Следующая страница реферата
![]()
Таким образом, можно убедиться, что хлор более сильный окислитель, чем бром. Точно так же, если смешать раствор иодида калия с бромом, образуется черный осадок из твердого иода. Это означает, что бром окисляет иодид-ионы:
![]()
Обе описанные реакции являются примерами реакций вытеснения (замещения). В каждом случае более реакционноспособный, то есть являющийся более сильным окислителем, галоген вытесняет из раствора менее реакционноспособный галоген.
Окисление металлов. Галогены легко окисляют металлы. Фтор легко окисляет все металлы, исключая золото и серебро. Мы уже упоминали о том, что хлор окисляет натрий, образуя с ним хлорид натрия. Приведем еще один пример: когда поток газообразного хлора пропускают над поверхностью нагретых железных опилок, образуется хлорид железа (III), твердое коричневое вещество:
![]()
Даже иод способен, хотя и медленно, окислять металлы, расположенные в электрохимическом ряду ниже его. Легкость окисления металлов различными галогенами уменьшается при перемещении к нижней части VII группы. В этом можно убедиться, сравнивая энергии образования галогенидов из исходных элементов. В табл. 4 указаны стандартные энтальпии образования галогенидов натрия в порядке перемещения к нижней части группы.
Окисление неметаллов. За исключением азота и большинства благородных газов, фтор окисляет все остальные неметаллы. Хлор реагирует с фосфором и серой. Углерод, азот и кислород не вступают в реакции непосредственно с хлором, бромом или иодом. Об относительной реакционной способности галогенов к неметаллам можно судить, сравнивая их реакции с водородом (табл. 5).
Окисление углеводородов. При определенных условиях галогены окисляют углеводороды. Например, хлор полностью отщепляет водород от молекулы скипидара:
![]()
Окисление ацетилена может протекать со взрывом:
![]()
Таблица 5. Реакции галогенов с водородом
| Реакция | Характер и условия протекания |
| Н2(г.)+F2(г.) ® 2НF (г.) | Протекает со взрывом |
| Н2(г.)+Сl2(г.) ® 2НСl (г.) | Протекает со взрывом на свету, но медленно в темноте |
| Н2(г.)+Вr2(г.) ® 2НВr (г.) | Протекает только при нагревании и в присутствии катализатора |
| Н2(г.)+I2(г.) ® 2НI (г.) | Протекает медленно даже при нагревании |
Реакции с водой и щелочами
Фтор реагирует с холодной водой, образуя фтороводород и кислород:
![]()
Хлор медленно растворяется в воде, образуя хлорную воду. Хлорная вода имеет небольшую кислотность вследствие того, что в ней происходит диспропорционирование хлора с образованием соляной кислоты и хлорноватистой кислоты:
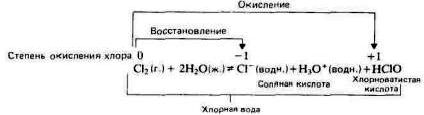
Бром и иод диспропорционируют в воде аналогичным образом, но степень диспропорционирования в воде уменьшается от хлора к иоду.
Хлор, бром и иод диспропорционируют также в щелочах. Например, в холодной разбавленной щелочи бром диспропорционирует на бромид-ионы и гипобромит-ионы (бромат (I)-ионы):
![]()
При взаимодействии брома с горячими концентрированными щелочами диспропорционирование протекает дальше:
![]()
Иодат (I), или гипоиодит-ион, неустойчив даже в холодных разбавленных щелочах. Он самопроизвольно диспропорционирует с образованием иодид-иона и иодат(V)-иона.
Реакция фтора со щелочами, как и его реакция с водой, не похожа на аналогичные реакции других галогенов. В холодной разбавленной щелочи протекает следующая реакция:
Рекомендуем скачать другие рефераты по теме: русский язык 9 класс изложения, реферат современная россия.
Предыдущая страница реферата | 1 2 3 4 | Следующая страница реферата