
Серная кислота
Категория реферата: Рефераты по науке и технике
Теги реферата: титульный дипломной работы, красный диплом
Добавил(а) на сайт: Davydkin.
1 2 3 4 5 | Следующая страница реферата
Серная кислота.
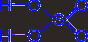 Физические свойства.
Физические свойства.
Чистая 100 %-ная серная кислота (моногидрат) представляет собой бесцветную маслянистую жидкость, застывающую в кристаллическую массу при +10 °С. Реактивная серная кислота имеет обычно плотность 1,84 г/см3 и содержит около 95 % H2SO4. Затвердевает она лишь ниже -20 °С.
Температура плавления моногидрата равна 10,37 °С при теплоте плавления 10,5 кДж/моль. В обычных условиях он представляет собой очень вязкую жидкость с весьма высоким значением диэлектрической проницаемости (e = 100 при 25 °С). Незначительная собственная электролитическая диссоциация моногидрата протекает параллельно по двум направлениям: [Н3SO4+]·[НSO4-] = 2·10-4 и [Н3О+]·[НS2О7-] = 4·10-5. Его молекулярно-ионный состав может быть приближенно охарактеризован следующими данными (в %):
H2SO4 HSO4- H3SO4+ H3O+ HS2O7- H2S2O7
99,5 0,18 0,14 0,09 0,05 0,04
При добавлении даже малых количеств воды преобладающей становится диссоциация по схеме:Н2О + Н2SО4 Н3О+ + НSO4-
Химические свойства.
H2SO4 - сильная двухосновная кислота.
H2SO4 H+ + HSO4- 2H+ + SO42-
Первая ступень (для средних концентраций) приводит к 100%-ой диссоциации:
K2 = ([H+] · [SO42-]) / [HSO4-] = 1,2 · 10-2
1) Взаимодействие с металлами:
a) разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода:
Zn0 + H2+1SO4(разб) --> Zn+2SO4 + H2O
b) концентрированная H2+6SO4 - сильный окислитель; при взаимодействии с металлами (кроме Au, Pt) может восстанавливаться до S+4O2, S0 или H2S-2 (без нагревания не реагируют также Fe, Al, Cr - пассивируются):
2Ag0 + 2H2+6SO4 --> Ag2+1SO4 + S+4O2 + 2H2O
8Na0 + 5H2+6SO4 --> 4Na2+1SO4 + H2S-2 + 4H2O
2) концентрированная H2S+6O4 реагирует при нагревании с некоторыми неметаллами за счет своих сильных окислительных свойств, превращаясь в соединения серы более низкой степени окисления, (например, S+4O2):
С0 + 2H2S+6O4(конц) --> C+4O2 + 2S+4O2 + 2H2O
S0 + 2H2S+6O4(конц) --> 3S+4O2 + 2H2O
2P0 + 5H2S+6O4(конц) --> 5S+4O2 + 2H3P+5O4 + 2H2O
3) с основными оксидами:
CuO + H2SO4 --> CuSO4 + H2O
CuO + 2H+ --> Cu2+ + H2O
4) с гидроксидами:
Рекомендуем скачать другие рефераты по теме: класс, виды шпор.
1 2 3 4 5 | Следующая страница реферата