
Серная кислота
Категория реферата: Рефераты по науке и технике
Теги реферата: титульный дипломной работы, красный диплом
Добавил(а) на сайт: Davydkin.
Предыдущая страница реферата | 1 2 3 4 5
2) метод "кипящего слоя"
3) 800°С; отвод лишнего тепла
4) увеличение концентрации кислорода в воздухе
2-я стадия. После очистки, осушки и теплообмена сернистый газ поступает в контактный аппарат, где окисляется в серный ангидрид (450°С - 500°С; катализатор V2O5):
2SO2 + O2 2SO3
3-я стадия. Поглотительная башня:
nSO3 + H2SO4(конц) --> (H2SO4 · nSO3)(олеум)
Воду использовать нельзя из-за образования тумана. Применяют керамические насадки и принцип противотока.
Применение.
Помните! Серную кислоту нужно вливать малыми порциями в воду, а не на оборот. Иначе может произойти бурная химическая реакция, в результате которой человек может получить сильные ожоги.
Серная кислота — один из основных продуктов химической промышленности. Идет на производство минеральных удобрений (суперфосфат, сульфат аммония), различных кислот и солей, лекарственных и моющих средств, красителей, искусственных волокон, взрывчатых веществ. Применяется в металлургии (разложение руд, напр. урановых), для очистки нефтепродуктов, как осушитель и др.
Практически важно то обстоятельство, что очень крепкая (выше 75 %) серная кислота не действует на железо. Это позволяет хранить и перевозить её в стальных цистернах. Напротив, разбавленная H2SO4 легко растворяет железо с выделением водорода. Окислительные свойства для неё вовсе не характерны.
Крепкая серная кислота энергично поглощает влагу и поэтому часто применяется для осушки газов. От многих органических веществ, содержащих в своём составе водород и кислород, она отнимает воду, что нередко используется в технике. С этим же (а также с окислительными свойствами крепкой H2SO4) связано её разрушающее действие на растительные и животные ткани. Случайно попавшую при работе на кожу или платье серную кислоту следует тотчас же смыть большим количеством воды, затем смочить пострадавшее место разбавленным раствором аммиака и вновь промыть водой.
Молекулы чистой серной кислоты.
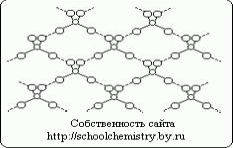
Рис.1. Схема водородных связей в кристалле H2SO4.
Молекулы, образующие кристалл моногидрата, (НО)2SO2 соединены друг с другом довольно сильными (25 кДж/моль) водородными связями, как это схематически показано на рис. 1. Сама молекула (НО)2SO2 имеет структуру искаженного тетраэдра с атомом серы около центра и характеризуется следующими параметрами: (d(S-ОН) = 154 пм, РНО-S-ОН = 104°, d(S=O) = 143 пм, РOSO = 119°. В ионе HOSO3-, d(S-ОН) = 161 и d(SO) = 145 пм, а при переходе к иону SO42- тетраэдр приобретает правильную форму и параметры выравниваются [d(SO) = 148 пм].Кристаллогидраты серной кислоты.
Для серной кислоты известно несколько кристаллогидратов, состав которых показан на рис. 14. Из них наиболее бедный водой представляет собой соль оксония: H3O+HSO4-. Так как рассматриваемая система очень склонна к переохлаждению, фактически наблюдаемые в ней температуры замерзания лежат гораздо ниже температур плавления.
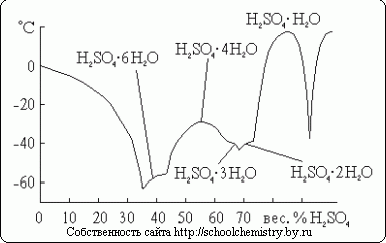
Рис. 14. Температуры плавления в системе H2O·H2SO4.
Скачали данный реферат: Искрицкий, Mitin, Фиста, Janovich, Ворожцов, Севостьянов.
Последние просмотренные рефераты на тему: строительные рефераты, ответы 10 класс, борьба реферат, план дипломной работы.
Предыдущая страница реферата | 1 2 3 4 5