
Жидкостное химическое травление
Категория реферата: Рефераты по науке и технике
Теги реферата: матершинные частушки, изложение 7 класс
Добавил(а) на сайт: Arsenij.
Предыдущая страница реферата | 1 2 3 4 5 | Следующая страница реферата
Рассмотрим механизм переноса для двух основных типов реакций - диффузионно-контролируемых и ограниченных скоростью реакции. Вообще говоря, в процессе травления могут быть вовлечены все три агрегатных состояния вещества:
твердая фаза ®скрытая химическая энергия и физическая структура пленки; жидкая фаза ®перенос ионов в жидком диэлектрике, обладающем высокой вязкостью; газообразная фаза®хемосорбция, рекомбинация, ионизация и средний свободный пробег газовых частиц при пониженном давлении Феноменологический механизм травления.Переход от твердой фазы к жидкой или газообразной
твердая пленка+ травитель ѕk® продукты (14)зависит от диффузии взаимодействующих веществ
SiO2(тв.)+6HF(жидк.) ®H2SiF6+2H2O, (15)SiO2+CF4 ® SiF4+CO2. (16)
Пусть r есть соотношение молярных объемов
r=(m/d)/(M/D), (17)где m и М - молекулярные веса продукта и травителя, а d и D - соответствующие плотности. Тогда, если r>1 (как при травлении стекла), продукт не покрывает полностью твердую поверхность (рис.6). Поскольку продукт не препятствует проникновению травителя, скорость травления определяется скоростью реакции травителя с твердой поверхностью [k в уравнении 14]. Энергии активации при этом порядка 7 - 20 ккал/моль. В случае r
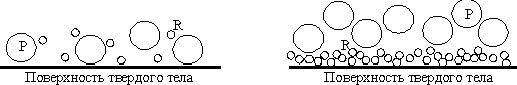 |
|
| Рис. 6. Продукт (Р) не плотно покрывает поверхность, и реагент (R) имеет к ней доступ. | Рис. 7. Продукт (Р) полностью покрывает травящуюся поверхность и блокирует доступ к ней реагента (R). |
Основные диффузионные модели были разработаны Фиком. Фундаментальным является предположение о том, что процессы диффузии и теплопроводности описываются одним и тем же типом уравнений. На поверхности твердого тела существует граница концентрации (рис. 8).
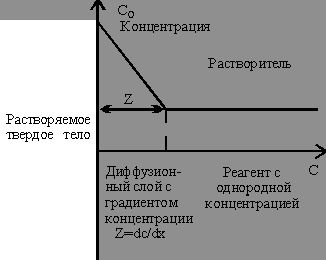 |
| Рис. 8. Растворение твердого тела в жидком травителе. Растворенные молекулы диффундируют сквозь насыщенный слой в область меньшей концентрации. |
Количество вещества dM, диффундирующее через поперечную площадку S за время dt, пропорционально S и, исходя из размерности dM, градиенту концентрации dC/dx в точке x на поверхности твердого тела площадью S
dM/dt=-DSdC/dx, (18)где D - коэффициент диффузии в см2/сек (аналогично коэффициенту температуропроводности).Предполагается, что поперечная площадки (S) не меняется в процессе травления. При жидкостном проявлении, однако, обычно происходит отрывание резиста, что ведет к увеличению S. При ионно-плазменном или реактивно-ионном травлении может происходить эрозия резиста. Из соотношения Эйнштейна-Стокса следует. что коэффициент диффузии D зависит от вязкости (h):
D=RT/h, (19)dM/dt=скорость травления =D=1/h, (20)
hD=constT, (21)
h=exp(Evis/RT), (22)
Evis=Eetch. (23)
Различают три основных типа твердофазного травления :
химический процесс на поверхности идет медленно, и наблюдаемая скорость является скоростью поверхностного процесса [r>1, уравнение 17]; химический процесс на поверхности настолько быстр, что конвекция и диффузия не могут обеспечивать достаточной концентрации реагента у поверхности, r>1. Наблюдаемая скорость является скоростью переноса (диффузии) к поверхности; скорость диффузии и химической реакции одного порядка (потребление реагента в реакции соизмеримо с его переносом в результате диффузии), однако концентрация реагента на поверхности не снижается на столько , чтобы сдерживать реакцию. Простейший пример уравнения для скорости - процесс типа (1)dM/dt= k1SC, (24)
где S - площадь поверхности, С - концентрация травителя.
Здесь предполагается, что скорость имеет первый порядок по отношению к концентрации травителя, и не учитывается промежуточное поглощение и влияние неровностей поверхности. В реакциях типа (2) необходимо учитывать эффективную толщину (s) слоя градиента концентрации (рис. 8) и применять закон Фика [уравнения 18 и 19]:
dM/dt=DSC/s=k2SC. (25)В процессах типа (3) предполагается, что концентрация травителя на поверхности равна Сs (s-ІsurfaceІ):
dM/dt=k1SCs=k2S(C-Cs). (26)Если разность эффективных площадей учитывается в k1, то
dM/dt=k1k2SC/(k1+k2)=k3SC (27)Уравнения (24), (25), (26) формально представляют одно и то же уравнение, и поэтому необходимо располагать экспериментальным критерием для различения трех описанных типов травления. Некоторые отличия приводятся ниже. Характерными признаками реакции, контролируемой диффузией, являются:
Энергия активации зависит от вязкости и равна 1-6 ккал/моль [уравнение 23]. Скорость реакции увеличивается при перемешивании реагента. Исключение составляет эффект автокатолиза NO при травлении кремния в HNO3. Продукты этой реакции (NO) способствуют ее же развитию. Интенсивное перемешивание приводит к уменьшению скорости реакции. Все материалы независимо от ориентации кристаллических плоскостей травятся с одинаковой скоростью. Энергия активации при перемешивании растет. Исключением является травление кремния в HNO3 (DH=100 ккал/моль), в ходе которого значительное количество тепла, выделяемое в результате экзотермической реакции, приводит к увеличению скорости диффузии и скорости травления. Перемешивание в этом случае привело бы к уменьшению скорости травления из-за диссипации тепла. Характерными признаками процессов, контролируемых скоростью химической реакции [уравнение 24], являются: зависимость скорости реакции от концентрации травителя; 2) отсутствие зависимости скорости от перемешивания; 3) энергия активации составляет 8-20 ккал/моль. Жидкостное травление.При жидкостном травлении металлов происходят окислительно-восстановительные реакции, а в случае неорганических оксидов - реакции замещения (кислотно-основные).
Травление SiO2.Амфорный или плавленый кварц,- это материал, в котором каждый атом кремния имеет тетраэдрическое окружение из четырех атомов кислорода. В стеклообразных материалах могут сосуществовать как кристаллическая, так и аморфная фазы. Напыленный кварц представляет собой аморфный SiO2 из тэтраэдров SiO4. В процессе реакции травления элементарный фтор может легко замещать атом О в SiO2, так как фтор обладает меньшим ионным радиусом (0.14 нм), чем SiѕO (16 нм). Энергия связи SiѕF в 1.5 раза превышает энергию связи SiѕO. Ниже перечислены основные достоинства аморфных пленок SiO2, применяемых в полупроводниковой электронике: хорошая диэлектрическая изоляция; барьер для ионной диффузии и имплантации; низкие внутренние напряжения; высокая степень структурного совершенства и однородности пленки; использование в качестве конформных покрытий, включая и покрытия ступенек; высокая чистота, однородная плотность и отсутствие сквозных пор.
Аморфный SiO2 различных типов получают методами химического осаждения из паровой фазы, распыления, окисления в парах воды. Из-за внутренних напряжений оксиды, осажденные различными способами, имеют различия в строении ближнего порядка, которые влияют на скорость травления (табл. 3).
Таблица 3. Скорости травления SiO2 в буферном растворе (7;1) HF.
| Метод получения оксида | Относительная скорость травления (мкм/мин) |
| Термоокисление в парах воды1) Анодный рост Пиролитический Распыление Легированный оксид |
1.0 8.5 3-10 0.5 3-5 |
1) Примерно 0.1 мкм/мин (20оС).
Травление SiO2 в водном растворе HF через фоторезистную маску протекает изотропно благодаря эффекту подтравливания, который усиливается частичным отслаиванием резиста. Почти анизотропные вертикальные профили могут быть получены при использовании твердой и свободной от напряжений масок из Si3N4 (рис. 9). Косые кромки получают при использовании 30:1 (по весу) раствора NH4F в HF. Ухудшение адгезии резиста или, наоборот, его хорошее сцепление (Si3N4) с поверхностью SiO2 может привести к возникновению трех различных профилей травления. Химия травления SiO2 включает нуклеофильное воздействие фторидных групп на связи SiѕO. В буферном растворе HF (7 частей 40-процентной NH4F к одной части концентрированной HF) доминируют два типа частиц:
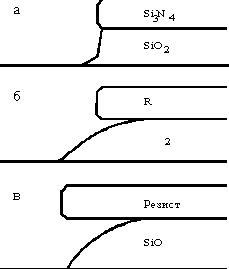 |
| Рис. 9. профили полученные при использовании жидкостного травителя 6:1 NH4/HF с различными масками: а-маска Si3N4; б-фоторезистная маска. В случае (в) травление в смеси 30:1 NH4F/HF проводилось через маску фоторезиста. |
F ѕk1® H+ + F-, k1=10-3, (28)
HF+F- ѕk2® HF-2, k2=10-1. (29)
Основной частицей в буферном растворе HF является HF-2. Эта система чувствительна к перемешиванию и, скорее всего, является диффузионно-контролируемой. На рис. 10 показана линейная зависимость скорости растворения от концентрации HF-2 и HF. Таким образом, скорость уменьшения толщины SiO2 равна
d(SiO2)/dt=A(HF)+B(HF-2)+C, (30)где А, В и С - постоянные, при 250С равные 2, 5 и 9.7 соответственно.
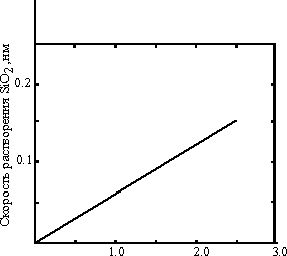 |
| Рис. 10. Линейность скорости растворения SiO2 при 23оС. |
Неразбавленный раствор HF диссоциирует только до 10-3, и скорость травления в нем примерно в 4 раза меньше (0.925 мкм/мин). Неразбавленный раствор HF является также хорошо проникающим веществом, и поэтому он легко диффундирует сквозь резистную пленку, создавая в ней каналы и случайные отслоения от подложки.
Можно представить, что атака бифторидным ионом поверхности диоксида кремния включает промежуточное состояние
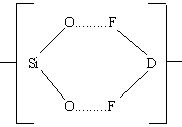
Во взаимодействии HF с оксидом кремния участвуют, вероятно, поверхностные состоянии
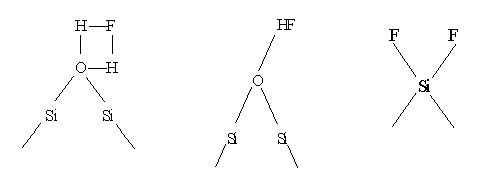
Рекомендуем скачать другие рефераты по теме: заключение реферата, текст для изложения.
Предыдущая страница реферата | 1 2 3 4 5 | Следующая страница реферата