
Синтез хлорида олова (IV)
Категория реферата: Биология и химия
Теги реферата: доклад по обж, реферат
Добавил(а) на сайт: Majsak.
Предыдущая страница реферата | 1 2 3 4 5 6 7 8 | Следующая страница реферата
Рефераты | Биология и химия | Синтез хлорида олова (IV)
Синтез хлорида олова (IV)Категория реферата: Биология и химия Теги реферата: доклад по обж, реферат Добавил(а) на сайт: Majsak. Предыдущая страница реферата | 1 2 3 4 5 6 7 8 | Следующая страница реферата |
-215 |
Для олова получены и все четыре дигалогенида.
Дихлорид SnCl2 – бесцветное кристаллическое вещество; легко растворяется в воде, спирте, эфире, ацетоне. Из водных растворов кристаллизуется в виде SnCl2 • 2Н2О («оловянная соль»). В водном растворе SnCl2 подвергается гидролизу, который протекает в существенно меньшей степени, чем в случае SnCl4, так как основные свойства у олова(П) выражены сильнее, чем у олова(IV):
SnCl2 + H2O = Sn(OH)Cl + HCl.
В растворе содержатся не только SnOH+, но и более сложные полимерные ионы, например [Sn3(OH)4]2+ и [Sn(OH)2Cl2]2-, которые могут взаимодействовать между собой.
Твердый SnCl2 также имеет полимерное строение. Его слоистая структура составлена из тригонально-пирамидальных групп [SnCl3], связанных друг с другом через атомы хлора:
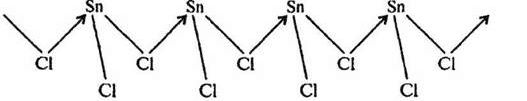
Рис. 2. Строение SnCl2.
В парах SnCl2 представляет собой угловую молекулу: угол ClSnCI составляет 95o. Несвязывающая электронная пара олова направлена к вершине треугольника. Характер связи (наложение ковалентной и ионной составляющих) Sn–Cl в SnCl2 и SnCl4 одинаков, но из-за цепочечного характера связей в твердом состоянии SnCl2 менее устойчив и легко диспропорционирует:
2SnCl2 = SnCl4 + Sn.
Дихлорид SnCl2 — сильный восстановитель. Он восстанавливает из растворов солей до металлов золото, серебро, ртуть, висмут, Fe3+ до Fe2+, хроматы до Сг3+ , перманганаты до Мn2+ , нитрогруппу до аминогруппы, бром до бромид-иона, сульфит-ион до серы, например:
2SnCl2 + H2SO3 + (2x + l)H2O = 2SnO2*xH2O + S + 4HCI
или
2SnCl2 + H2SO3 + 8НС1 = S + 2H2[SnCl6] + 3H2O,
SnCl2 + Br2 + (2 + x)H2O = 2HC1 + 2HBr + SnO2 • xH2O
или
3SnCl2 + 3Br2 + (2 + x)H2O = H2[SnCI6] + H2[SnBr6] + SnO2 • xН2О.
В водном растворе SnCI2 медленно окисляется кислородом воздуха. Чтобы препятствовать этому, в раствор добавляют металлическое олово. Остальные дигалогениды олова весьма сходны по свойствам с SnCl2.
Дигалогениды олова синтезируют нагреванием олова в токе галогеноводорода или осторожным обезвоживанием кристаллогидратов SnX2 • nН2О, полученных растворением олова в соответствующих галогеноводородных кислотах. Безводные SnX2 можно получить также непосредственным взаимодействием галогенов с избытком олова.
Все дигалогениды олова образуют комплексы (ЩЭ)[SnХз] и (ЩЭ)2lSnX4], но они менее устойчивы, чем производные олова(IV). Получают их в растворах соответствующих галогеноводородных кислот или их солей по реакции
SnX2 + 2NaX = Na2[SnX4].
В концентрированных растворах равновесие смешено вправо, при разбавлении смещается влево. Устойчивость галогенидных комплексов изменяется в следующем ряду: F > CI > Вг > I.
Многие галогениды олова, такие как SnCI4, SnCI2, а также продукты их гидролиза, например, Na2[Sn(OH)6], используют в качестве протрав при крашении тканей. Тетрахлорид SnCl4 применяют для приготовления дымовых завес и в качестве катализатора при хлорировании, а в органической химии — как стимулятор процесса конденсации. [3]
Таблица 2. Свойства дигалогенидов олова
|
SnX2 Рекомендуем скачать другие рефераты по теме: шпоры по менеджменту, реферат чрезвычайные ситуации. Предыдущая страница реферата | 1 2 3 4 5 6 7 8 | Следующая страница реферата Поделитесь этой записью или добавьте в закладкиКатегории: |