
Синтез хлорида олова (IV)
Категория реферата: Биология и химия
Теги реферата: доклад по обж, реферат
Добавил(а) на сайт: Majsak.
Предыдущая страница реферата | 1 2 3 4 5 6 7 8 | Следующая страница реферата
Рефераты | Биология и химия | Синтез хлорида олова (IV)
Синтез хлорида олова (IV)Категория реферата: Биология и химия Теги реферата: доклад по обж, реферат Добавил(а) на сайт: Majsak. Предыдущая страница реферата | 1 2 3 4 5 6 7 8 | Следующая страница реферата |
720 |
Оранжево-красный |
Нерастворим |
-152 |
Молекулы тетраголагенидов ЭНаl4 имеют форму тетраэдра с атомом Э в центре. По мере увеличения размеров орбиталей в ряду GeHal4 - SnHal4 - PbHal4 устойчивость молекул заметно падает. Тетрабромид и тетраиодид свинца не известны.
В твердом состоянии тетрагалогениды, за исключением SnF4 и PbF4, имеют молекулярную решетку. Поэтому они легкоплавки и летучи. В обычных условиях GeF4 - газ, а ЭСl4 - жидкости, а ЭI4 - кристаллические вещества.
За исключением оранжевого GeI4 и желтых SnI4 и РbСl4, тетрагалогениды германия и его аналогов бесцветны.
Резкое возрастание температур плавления и кипения при переходе от GeF4 (т. пл. - 15 °С) к SnF4 (т. возг. 700 °С) и PbF4 (т. пл. ~ 600 °С) является следствием перехода от молекулярной решетки к полимерной. Кристаллы SnF4 и PbF4 имеют слоистую решетку, состоящую из октаэдрических структурных единиц. Таким образом, в PbF4 достигается устойчивое координационное число атома Рb - 6, и это соединение в отличие от других галогенидов свинца (IV) устойчиво.
Тетрагалогениды взаимодействуют также с основными галогенидами:
2KF + ЭF4 = K2[ЭF6]
Для Ge(IV), как и для Si(IV), характерны фторокомплексы [GeF6] 2-. Но получен и малостойкий Cs2[GeCl6]. Для Sn(IV) и Pb(IV) известны комплексные галогениды всех типов от M2[ЭF6] до М2[ЭI6]. Это свидетельствует о стабилизации у свинца степени окисления +4 в анионных комплексах с координационным числом 6. Галогенидные комплексы германия и олова устойчивы как в растворе, так и в кристаллических соединениях. Аналогичные соединения свинца легко гидролизуются. [2]
На основании приведённых данных можно выделить следующие методы синтеза хлорида олова (IV):
Первый способ.
Удобный способ получения безводного SnCl4 основан на прямом синтезе:
Sn + 2Cl2 = SnCl4
Большую пробирку (длина 20—25 см, диаметр 3—4 см) заполняют на 3/4 гранулированным оловом. Пробирку закрывают пробкой с двумя отверстиями: в одно вставляют газоподводящую трубку, а другое — форштосс обратного холодильника (рис.3).
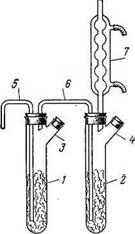
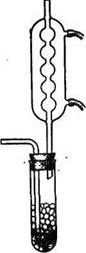
Рис. 3. Прибор для получения хлорного олова
Рис. 4. «Сдвоенный» прибор для получения хлорного олова:
1,2 — пробирки; 3,4 — тубусы; 5 — хлорподводящая трубка; 6 — соединительная трубка; 7—шариковый холодильник.
В пробирку наливают несколько миллилитров готового SnCl4 и пропускают (под тягой) сухой хлор с такой скоростью, чтобы газ успевал прореагировать с оловом. Реакция протекает бурно, иногда с появлением пламени. Когда на дне пробирки соберется значительный слой SnCl4, газоподводящую трубку несколько поднимают, но конец ее должен быть погружен в жидкость. По окончании реакции SnCl4 сливают в склянку, вносят несколько гранул Sn для связывания свободного хлора и выдерживают 1 ч в закрытой склянке. Затем жидкость перегоняют, собирая фракцию, кипящую при 112—114 oС (приемник для предохранения от влаги воздуха снабжают хлоркальциевой трубкой). Если исходное олово содержало Fe, то перегонку SnCl4 не следует доводить до конца (во избежание перехода примеси FeCl3). Полученный препарат переливают в склянку со стеклянной или корковой (но не резиновой!) пробкой.
Для приготовления большого количества SnCl4 (до 3 кг в день) рекомендуется прибор, изображенный на рис. 4. Две пробирки 1 и 2 (длина 20—25 см, диаметр 4 см) с тубусами 3 и 4 соединяют трубкой 6. К пробирке 2 присоединяют обратный холодильник 7. Пробирки заполняют на 3/4 гранулированным оловом и по трубке 5 пропускают ток сухого хлора, сначала медленно, во избежание сильного разогревания, затем, когда трубка 5 окажется погруженной в SnCl4, быстрее.
Когда пробирка 1 почти заполнится SnCl4 (пробирка 2 к этому времени наполняется приблизительно до половины) ток хлора прекращают, под трубку 5 подставляют сухую склянку и через верхнее отверстие холодильника 7 с помощью резиновой груши в прибор подают струю воздуха. При этом SnCl4 почти полностью переливается в подставленную склянку. Затем пробирки снова заполняют через тубусы оловом и продолжают хлорирование. Для очистки препарат перегоняют, добавив немного листового олова для связывания растворённого хлора. Собирают фракцию, кипящую при 112-114 оС.
Выход 90-95%. [5]